Оглавление
- 1 Гепаторенальный синдром (K76.7)
- 2 Этиология острой почечной недостаточности у кошек
- 3 Острая почечная недостаточность (ОПН, Acute Renal Failure, АFR)
Гепаторенальный синдром (K76.7), Hepatorenal Syndrome (HRS), Гепаторенальный синдром (ГРС) — тяжелая функциональная острая почечная недостаточность у больных, имеющих выраженную печеночную недостаточнос
Гепаторенальный синдром (K76.7)
Гепаторенальный синдром (ГРС) — тяжелая функциональная острая почечная недостаточность у больных, имеющих выраженную печеночную недостаточность в результате острого или хронического заболевания печени, причем другие причины почечной недостаточности (прием нефротоксических препаратов, обструкция Обструкция — непроходимость, закупорка
мочевыводящих путей, хронические заболевания почек и прочие) отсутствуют. Морфологически почки при гепаторенальном синдроме почти не изменены, отмечается сокращение количества мезангиальных клеток.
Из данной подрубрики исключены:
— "Послеродовая острая почечная недостаточность" — O90.4

Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
— 800 RUB / 4500 KZT / 27 BYN — 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Источник
Почечная недостаточность у кошек – одна из самых серьезных патологий, встречающихся довольно часто. Лечение зависит от формы патологии, общего состояния и возраста животного.
Если речь не идет об острой форме почечной недостаточности, то длительный период патология протекает в скрытой форме. Постепенно клетки отмирают, но почки продолжают работать. Характерные признаки почечной недостаточности появляются, когда объем поврежденных тканей — более 70 %.
Веселый и активный домашний питомец становится вялым, сонливым, быстро устает и большую часть времени лежит. Аппетит у него пропадает, жажда, наоборот, увеличивается. Несмотря на большое количество выпитой воды, кот редко ходит в туалет. Даже если ему удается пописать, то количество урины незначительное. Хозяин замечает, что пушистик постоянно лижет половые органы.
Далее возникают расстройство пищеварения — тошнота, диарея, запор.
Характерно появление резкого неприятного запаха от тела и пасти четвероногого любимца.
В тяжелых случаях у животного наблюдаются эпилептические припадки, судороги, повышение температуры, гипертония, в результате которой происходит разрыв сосудов в глазном яблоке и потеря зрения. Интоксикация организма нарастает, состояние кота стремительно ухудшается. Почки не работают, в результате чего питомец впадает в кому и умирает.

Источник
В обзоре представлены современные подходы по ведению пациентов с острым повреждением почек на различных этапах периоперационного периода. Послеоперационное острое повреждение почек является одним из самых серьезных осложнений во время госпитализации и увеличивает заболеваемость, смертность и продолжительность пребывания в стационаре. Частота встречаемости периоперационного острого повреждения почек зависит от характера оперативного вмешательства и колеблется в широком диапазоне — от 0,8 до 94%. В обзоре представлены диагностические критерии и классификация острого повреждения почек согласно рекомендациям Kidney Disease Improving Global Outcomes (KDIGO). Дано этиологическое и патогенетическое обоснование развития различных форм острого повреждения почек. Представлены рекомендации по профилактике и лечению острого повреждения почек на дооперационном, интраоперационном и послеоперационном периоде, сформулированные с позиции доказательной медицины. В частности, даны рекомендации по инфузионной терапии, контролю волемического статуса, гемодинамической и нутритивной поддержке, использованию диуретиков, профилактике контраст-индуцированного повреждения почек и коррекции режима введения нефротоксических препаратов. Обсуждены подходы к началу проведения и режимы заместительной почечной терапии.
Этиология острой почечной недостаточности у кошек
ПРИЛОЖЕНИЕ 2. Алгоритм ведения пациента. Периоперационная диагностика у пациентов с ХБП и риском развития ОПП
ПРИЛОЖЕНИЕ 3. Алгоритм ведения пациента. Периоперационная профилактика развития ОПП
Термины и определения
Под острым повреждением почек (ОПП) следует понимать быстрое развитие дисфункции органа в результате непосредственного воздействия ренальных или экстраренальных повреждающих факторов. ОПП — понятие, вошедшее в медицинскую практику сравнительно недавно и повсеместно заменившее известный термин — острая почечная недостаточность.
Под хронической болезнью почек (ХБП) следует понимать наличие любых маркеров, связанных с повреждением почек и персистирующих в течение более 3 мес вне зависимости от нозологического диагноза.
Почечная недостаточность может быть хронической (ХПН) на фоне хронических болезней почек (ХБП) и острой вследствие острого повреждения почек.
Острое повреждение почек (ОПП) — широко распространенное и опасное состояние, которое, несмотря на совершенствование медицинских технологий, зачастую несвоевременно диагностируется и является причиной неблагоприятных исходов, в том числе летального.
Частота встречаемости периоперационного острого повреждения почек (ОПП) зависит от характера оперативного вмешательства. Наиболее высока она после протезирования аневризмы аорты — 15—46% [1] и у пациентов, перенесших трансплантацию печени, — 48—94%, 8—17% из этих больных требуют заместительной почечной терапии (ЗПТ) [2]. В кардиохирургии частота развития ОПП также высока и колеблется от 7,7 до 11,4% [3], потребность в диализной терапии составляет от 1 до 5% [4]. При этом частота ОПП зависит от вида кардиохирургического вмешательства. Для типичного аортокоронарного шунтирования (АКШ) она относительно низкая — около 2,5%, потребность в ЗПТ — около 1%; для операций на клапанах сердца эти показатели составляют 2,8 и 1,7%; при комбинированных операциях АКШ с протезированием клапанов данные показатели значительно выше — 4,6 и 3,3% соответственно [5]. При некардиохирургических вмешательствах частота развития ОПП существенно ниже — около 0,8% [6, 7], но при этом необходимо помнить, что пациенты данной категории составляют основную массу хирургических больных.
Послеоперационное ОПП является одним из самых серьезных осложнений в хирургии, увеличивая смертность и продолжительность пребывания пациентов в стационаре. Многочисленные исследования показали, что ОПП ассоциируется с повышением как краткосрочного, так и долгосрочного риска смерти (7-кратное увеличение по сравнению с пациентами без ОПП), а также с риском прогрессирования почечной недостаточности [8, 9]. После кардиохирургических операций летальность у пациентов с ОПП составила 9,5% по сравнению с 0,8% у пациентов без почечной дисфункции [10]. У пациентов некардиохирургического профиля, не имевших исходно почечной дисфункции, развитие ОПП после операции увеличивало 30-дневную, 60-дневную и 1-летнюю смертность соответственно с 2,7 до 15%, с 5,1 до 17% и с 15 до 31% [11].
В патогенетическом плане ОПП рассматривается, как совокупность механизмов, связанных с повреждением различных компартментов почки и приводящих к дисфункции органа. Этим определяется разнообразие причин снижения клубочковой фильтрации при ОПП.
Причины ОПП подразделяются на три основные группы, которые являются основой патогенетической классификации данного состояния [12]:
1) преренальные (связанные с гипоперфузией почек);
2) ренальные (связанные с прямым повреждением основных компартментов органа — внутрипочечных сосудов, клубочков, канальцев и интерстиция);
3) постренальные (связанные с постренальной обструкцией тока мочи).
Преренальное ОПП превалирует над другими вариантами, составляя 55—60%. Представляет функциональный ответ на почечную гипоперфузию и не ассоциируется с первоначальными структурными почечными повреждениями. В связи с этим при своевременном восстановлении нормальной почечной перфузии наблюдается быстрая нормализация почечной функции. В то же время при тяжелой пролонгированной почечной гипоперфузии может развиваться ишемический острый тубулярный некроз (ОТН).
Основные причины преренального ОПП [12]:
1) уменьшение внутрисосудистого объема жидкости;
2) вазодилатация, сопровождающаяся острым увеличением сосудистой емкости;
3) снижение сердечного выброса.
Патологические процессы в почках, приводящие к развитию ОПП, классифицируются в соответствии с морфологическими особенностями. Классически ренальный вариант ОПП разделяют на острые гломерулярные, интерстициальные и тубулярные повреждения.
Основные причины развития ренального ОПП [12]:
1) интерстициальный нефрит вследствие инфекции и аллергических реакций;
2) острый канальцевый некроз — влияние ишемии, экзо- и эндотоксинов;
3) гломерулонефрит и васкулит как проявление иммунных реакций.
Постренальное ОПП является результатом обструкции мочевыделительной системы (МВС), которая может иметь место на уровне мочевого пузыря или уретры (обструкция нижних отделов МВС) или на уровне мочеточников и почек (обструкция верхних отделов МВС). ОПП на уровне верхних отделов МВС должна быть билатеральной; при односторонней обструкции синдром ОПП обычно не развивается при сохранной функции контралатеральной почки [12].
Пациенты с сопутствующей ХБП подвержены риску дальнейшего усугубления почечной недостаточности во время госпитализации и хирургического вмешательства, поскольку хроническая патология почек является существенным фактором риска развития острого повреждения почек (ОПП) [13—16].
Признаки ХБП отмечаются более чем у 1/3 больных с хронической сердечной недостаточностью; снижение функции почек наблюдается у 36% лиц в возрасте старше 60 лет; у лиц трудоспособного возраста снижение функции отмечается в 16% случаев, а при наличии сердечно-сосудистых заболеваний его частота возрастает до 26% [17].
По данным литературы [18], летальность пациентов с ХБП после плановых хирургических вмешательств составляет 4%, после экстренных операций — до 47%, осложнения развиваются в 12—64% случаев.
Диагностические критерии ОПП и ХБП
В 2002 г. были впервые предложены временны́е критерии ОПП, отображающие тяжесть острой почечной дисфункции [19]. Они получили название — критерии RIFLE (Risk — риск, Injury — повреждение, Failure — недостаточность, Loss — потеря функции и End-stage renal disease — терминальная стадия почечной недостаточности). Критерии RIFLE диагностики и классификации острого повреждения почек представлены в приложении 4.
Группой экспертов Kidney Disease Improving Global Outcomes (KDIGO) в 2012 г. были модифицированы определение, критерии диагностики, стратификации тяжести ОПП и подготовлены подробные Клинические Рекомендации [20]. Согласно им, ОПП следует определять как наличие, как минимум, одного из следующих критериев:
— нарастание креатинина ≥0,3 мг/дл (≥26,5 мкмоль/л) в течение 48 ч или
— нарастание креатинина ≥1,5 раза от исходного, которое, как известно или предполагается, произошло в течение 7 сут, или
— объем мочи <0,5 мл/кг/ч в течение 6 ч.
Стадии ОПП предложено определять по следующим критериям KDIGO (табл. 1).  Таблица 1. Стадии ОПП [20]
Таблица 1. Стадии ОПП [20]
Современные критерии ХБП включают [21]:
1) выявление любых клинических маркеров повреждения почек, подтвержденных на протяжении периода длительностью не менее 3 мес;
2) наличие маркеров необратимых структурных изменений органа, выявленных однократно при прижизненном морфологическом исследовании органа или при его визуализации;
3) снижение скорости клубочковой фильтрации (СКФ) <60 мл/мин/1,73 м 2 , сохраняющееся в течение 3 и более месяцев, вне зависимости от наличия других признаков повреждения почек.
СКФ — 60—89 мл/мин/1,73 м 2 расценивают как начальное или незначительное ее снижение. Для установления ХБП в этом случае необходимо наличие маркеров почечного повреждения. При их отсутствии ХБП не диагностируется. Для лиц 65 лет и старше это расценивают как вариант возрастной нормы. Лиц моложе этого возраста относят в группу высокого риска развития ХБП и рекомендуют контроль состояния почек не реже 1 раза в год, активную профилактику ХБП.
Если СКФ ниже 60 мл/мин/1,73 м 2 наличие ХБП устанавливается даже при отсутствии каких-либо маркеров почечного повреждения. Трехмесячное ограничение в качестве временно́го параметра определения ХБП было выбрано потому, что в данные сроки острые варианты развития дисфункции почек завершаются выздоровлением или приводят к очевидным клинико-морфологическим признакам хронизации процесса.
Стадии ХБП определяются в зависимости от уровня клубочковой фильтрации (СКФ) (табл. 2).  Таблица 2. Стратификация стадий ХБП по уровню СКФ [21]
Таблица 2. Стратификация стадий ХБП по уровню СКФ [21]
Ведение пациента на дооперационном этапе
У пациентов с ХБП необходима тщательная оценка состояния водно-электролитного баланса в предоперационном периоде [22, 23]. У большинства пациентов с ХБП наблюдается умеренная задержка натрия и воды, тенденция к гиперкалиемии. Острая гиперкалиемия может возникнуть в результате приема различных лекарственных препаратов, например β-блокаторов, калийсберегающих диуретиков (спиронолактон), ингибиторов АПФ или антагонистов ангиотензина, нестероидных противовоспалительных препаратов и нефротоксинов (аминогликозиды, циклоспорины). Снижение почечной экскреции вызывает также гипермагниемию, что сопровождается мышечной слабостью и потенцированием эффекта недеполяризующих миорелаксантов [24].
Дегидратация усугубляет поражение почек и в случае предшествующего голодания некоторым пациентам показано проведение инфузионной терапии. При расчете потребности в жидкости необходимо рассчитывать ее допустимое суточное количество. Объем инфузионной терапии должен покрывать неощутимые потери и объем мочи пациента. Следует избегать растворов, содержащих калий. Перед проведением очередного сеанса диализа у пациента нередко отмечается гипергидратация и, напротив, если диализ был только что выполнен — гиповолемия.
При подготовке к операции пациента с ХПН необходимо определить его так называемый «сухой вес» [25]. «Сухой вес» — это наименьший вес, переносимый больным без появления таких нежелательных симптомов, как гипотония, мышечные судороги, тошнота, рвота; обычно он оценивается клинически. Правильное определение «сухого веса» имеет очень большое значение для предотвращения интрадиализной гипотонии или, наоборот, перегрузки жидкостью в междиализном периоде. При проведении диализа на место выводимой из организма жидкости в сосудистое русло поступает жидкость, содержащаяся в тканях, количество которой зависит от объема межклеточного пространства. В случаях, когда масса тела пациента опускается ниже истинного «сухого веса», часто развиваются эпизоды гипотонии.
Инструментальные методы определения «сухого веса» [25]:
— Биоимпедансометрия. Позволяет оценить общий волемический статус, вне- и внутриклеточные водные сектора.
— Диаметр нижней полой вены. Обнаружена зависимость между диаметром нижней полой вены, давлением в правом желудочке и объемом циркулирующей крови. Определение следует проводить через 1—2 ч после сеанса диализа. У пациентов с выраженной дисфункцией левого желудочка данная методика недостаточно точна.
У пациентов, находящихся на программном диализе, оптимальное время для планового хирургического вмешательства — следующий день после очередного сеанса диализа [25].
Если диализ выполняется в день операции, то после его окончания необходимо выждать 4—6 ч, что необходимо для уравновешивания водных секторов и устранения остаточной гепаринизации [25]. У пациента на фоне хирургической патологии могут возникнуть показания к экстренному диализу в предоперационном периоде (т.е. выполнение оперативного вмешательства возможно только после проведения диализа) [25]:
— гиперкалиемия (K+ >6,0 ммоль/л);
— перегрузка жидкостью и отек легких;
— уремическая интоксикация и кома.
Для пациентов с ХБП типична нормохромная нормоцитарная анемия. Снижение почечной продукции эритропоэтина приводит к нарушению трансформации стволовых клеток костного мозга в эритроциты. Кроме этого, уремические токсины сокращают время жизни эритроцитов. Хроническая кровопотеря из верхних отделов желудочно-кишечного тракта (ЖКТ) и диализные потери еще более усугубляют эту проблему. Имеет место алиментарный дефицит железа и фолиевой кислоты [26].
При снижении концентрации гемоглобина ниже 110 г/л и гематокрита ниже 33% увеличивается частота послеоперационных осложнений. При подготовке к плановой операции следует откорректировать дозы эритропоэтина и препаратов железа, при необходимости дозу эритропоэтина можно увеличить до 150 ед/кг/нед. При предоперационной подготовке пациентов с гемоглобином ниже 90 г/л к большим операциям, или когда есть вероятность значительной кровопотери, следует провести трансфузию эритроцитов, что лучше всего выполнить во время очередного сеанса диализа.
При рассмотрении возможности регионарных методов анестезии у больных с ХБП необходимо помнить о риске кровотечения, обусловленного дисфункцией тромбоцитов. Оценить состояние системы гемостаза и, соответственно, риск периоперационного кровотечения необходимо на основании тромбоэластографии [25, 27].
Стандартный набор тестов обычно не показывает каких-либо отклонений (протромбиновое время/МНО, АЧТВ), число тромбоцитов также находится в пределах нормы [28]. Однако активность тромбоцитов под влиянием уремических токсинов обычно нарушена, что проявляется снижением их адгезивных и агрегационных свойств вследствие неадекватного высвобождения из сосудистого эндотелия комплекса фактора фон Виллебранда и фактора VIII, который в норме связывается и активирует тромбоциты. Нарушение адгезии тромбоцитов также связано с избыточной продукцией оксида азота [28]. Дисфункция тромбоцитов не может быть устранена при помощи трансфузии тромбоцитной массы, но степень ее выраженности снижается после проведения диализа. При необходимости быстрого улучшения свертывания крови может потребоваться трансфузия криопреципитата или введение десмопрессина, который усиливает высвобождение фактора фон Виллебранда (в России не зарегистрирован).
— Перед оперативным вмешательством необходимо своевременно выявить наличие факторов риска и ассоциированных состояний развития ОПП [7, 29]. Уровень достоверности (доказательности) В. Уровень убедительности рекомендации I.
Для некардиохирургических пациентов определены факторы риска и ассоциированные состояния развития ОПП (Приложение 5). Исходя из комбинации выше обозначенных факторов риска и ассоциированных состояний, определяется риск развития ОПП (табл. 3).  Таблица 3. Ориентировочная стратификация риска развития ОПП [20]
Таблица 3. Ориентировочная стратификация риска развития ОПП [20]
В кардиохирургии разработан ряд систем балльной оценки риска возникновения ОПП после операций с применением искусственного кровообращения [30]. Кливлендская система (Приложение 6) создана в результате анализа данных 33 217 пациентов. В ней используется 13 предоперационных факторов риска и возможность их оценки от 0 до 17 баллов. В группе низкого риска (0—2 балла) потребность в ЗПТ после операции возникала в 0,4% случаев, в то время как в группе высокого риска (9—13 баллов) этот показатель составил 21,5% [29].
Для максимально ранней диагностики вероятной ОПП у лиц с факторами риска и ассоциированными состояниями необходим мониторинг, как минимум, следующих параметров: массы тела, темпа диуреза, креатинина, мочевины и электролитов сыворотки крови; результаты мониторирования должны быть зарегистрированы в медицинской документации и подвергаться постоянному анализу [20].
Характерные лабораторные изменения у пациентов с ХБП и ОПП:
— азотемия (норма мочевины 5,2—8,4 ммоль/л);
— увеличение уровня креатинина (норма креатинина в крови: женщины — 53—97 мкмоль/л, мужчины — 62—115 мкмоль/л, дети до 1 года — 18—35 мкмоль/л, дети от 1 года до 14 лет — 27—62 мкмоль/л);
— гиперкалиемия (норма 3,5—5,5 ммоль/л);
— гипонатриемия (норма 130—150 ммоль/л);
— гипермагнеземия (1,0—1,15 ммоль/л).
Дополнительные лабораторно-инструментальные методы исследования у пациентов с ХБП или риском развития ОПП:
— общий анализ крови + тромбоциты;
— фракция экскреции натрия с мочой;
— УЗИ почек, мочевого пузыря;
— R-графия органов грудной клетки.
— У пациентов, соответствующим критериям ОПП или ХБП, необходимо рассчитать скорость клубочковой фильтрации (СКФ) [31]. Уровень достоверности (доказательности) А. Уровень убедительности рекомендации I.
СКФ (англ. — glomerular filtration rate, GFR) считается лучшей мерой оценки функции почек, и ее определение необходимо для обозначения стадии ОПП или ХБП, а также для коррекции доз препаратов, используемых в периоперационном периоде, которые элиминируются почечным механизмом. В норме СКФ ≥90 мл/мин/1,73 м 2 . Клинические проявления уремии появляются при снижении СКФ ниже 15 мл/мин/1,72 м 2 . СКФ вычисляется по формуле Кокрофта—Голта (Cockcroft—Gault) или по формуле MDRD (Modification Diet in Renal Disease) у взрослых; по формуле Шварца у детей [20].
СКФ=(140 – возраст)·масса тела (кг)/креатинин сыворотки (мкмоль/л).
Для мужчин полученное значение нужно умножить на 1,23 (большая доля мышечной массы в массе тела).
СКФ (мл/мин) = 186·[креатинин сыворотки (мкмоль/л)] – 1,154·[возраст] – 0,393·[0,742 для женщин].
СКФ = 0,55 × рост/креатинин сыворотки (мкмоль/л).
— У пациентов с высоким риском ОПП, но не имеющим на момент осмотра его критериев, рекомендуется определить биохимические маркеры ранней стадии ОПН [32]. Уровень достоверности (доказательности)A. Уровень убедительности рекомендации IIa.
К ранним биомаркерам ОПП относятся:
— полипептид, ингибитор цистеиновой протеазы;
— стабильно синтезируется клетками с ядрами;
— не подвержен влиянию таких факторов, как пол, масса тела, мышечная масса.
Цистатин С в сыворотке — маркер изменения СКФ — «быстрый креатинин». Цистатин С в моче — маркер повреждения канальцев.
NGAL — neutrophil gelatinase-associated lipocalin (липокалин, ассоциированный с желатиназой нейтрофилов):
— небольшая белковая молекула весом 25 kD;
— синтезируется клетками, находящимися в состоянии стресса (воспаление, ишемия и т. п.), в том числе почечным эпителием.
NGAL в моче указывает на активное повреждение почек — «тропонин почки». NGAL в плазме выявляет патофизиологическое состояние, связанное с развитием ОПП, — «холестерин ЛПНП» для почек. NGAL после повреждения почек в течение 2 ч повышается в сыворотке — в 7—16 раз, в моче — в 25—1000 раз [5].
— У пациентов с ХБП следует выполнить перед оперативным вмешательством исследование уровня альбуминурии/протеинурии [33]. Уровень достоверности (доказательности) В. Уровень убедительности рекомендации I.
Данный показатель имеет важное значение для оценки прогноза течения ХБП, риска сердечно-сосудистых осложнений, а также выбора тактики лечения (Приложение 7).
— Целевыми уровнями АД у пациентов с ХБП и артериальной гипертензией следует считать: у пациентов с незначительной альбуминурией (менее 30 мг/сут) — систолическое АД менее 140 мм рт.ст. и диастолическое менее 90 мм рт.ст.; при более высоком уровне альбуминурии или наличии протеинурии — систолическое АД менее 130 мм рт.ст. и диастолическое менее 80 мм рт.ст.: антигипертензивная терапия должна быть индивидуализирована, а снижения систолического АД менее 120 мм рт.ст. следует избегать [34]. Уровень достоверности (доказательности) A. Уровень убедительности рекомендации I.
Частота системной гипертензии у пациентов с ХБП достигает 80%. Увеличение объема циркулирующей плазмы, связанного с задержкой натрия и воды, является наиболее частой причиной гипертензии и эффективно поддается диализной терапии [35]. В некоторых случаях для адекватного контроля АД может потребоваться применение β-блокаторов, ингибиторов АПФ, α-блокаторов и вазодилататоров.
У пациентов с ХБП и артериальной гипертензией, нуждающихся в фармакологической коррекции для достижения целевых уровней артериального давления, в качестве препаратов первой линии или основного компонента комбинированного лечения следует назначать ингибиторы ангиотензинпревращающего фермента (иАПФ) или блокаторы АТ1-рецепторов ангиотензина II (БРА), если их применение не противопоказано [35].
Пациентам с ХБП c индексами альбуминурии/протеинурии А2—А3 и отсутствием артериальной гипертензии также следует назначать иАПФ или БРА с целью достижения антипротеинурического эффекта.
Интраоперационное ведение
Выбор анестезиологического пособия
В связи с низкой частотой развития ОПП рекомендуется использовать для анестезиологического пособия ингаляционные анестетики, пропофол, нейроаксиальную анестезию [36—40].
Исторически некоторые галогенсодержащие анестетики считаются нефротоксичными, например метоксифлуран, но он не используется в настоящее время в рутинной практике [41]. Изофлюран, десфлюран, галотан считаются безопасными для применения при ОПП и ХБП. Использование севофлурана связано с повышенными концентрациями фторида в плазме и с образованием галогеналкена, называемого «соединением А», однако препарат широко изучен и считается безопасным [42].
Показано, что при кардиохирургических вмешательствах анестезия с пропофолом связана со снижением частоты и тяжести ОПП [43].
Согласно метаанализу [44], частота ОПП ниже после нейроаксиальной анестезии по сравнению с общей анестезией. В другом метаанализе [45] показано снижение частоты развития ОПП при сочетании эпидуральной и общей анестезии в кардиохирургии. В когортном исследовании, проведенном D. Nash, R. Mustafa, E. McArthur и соавт. [46], было выявлено, что сочетание общей анестезии с нейроаксиальной сопровождается аналогичной по сравнению только с общей анестезией частотой ОПП.
У пациентов с ХБП требуется коррекция дозы анестезиологических препаратов в зависимости от уровня СКФ [47—51]. Дозы бензодиазепинов и барбитуратов должны быть снижены на 30—50% [48]. Хотя фармакодинамика пропофола при хронической почечной недостаточности не претерпевает изменений, а его метаболиты лишены седативных свойств, изменения объема распределения и исходного психического состояния больных вынуждают снижать индукционную дозу этого анестетика [48].
Большинство жирорастворимых анальгетиков метаболизируются в печени с образованием водорастворимых метаболитов, выводящихся путем почечной экскреции. Активность некоторых из этих метаболитов может значительно превышать активность исходного соединения [49]. При метаболизме морфина образуется морфин-6-глюкуронид, который обладает более мощными анальгетическими свойствами и сильнее подавляет дыхание. В связи со снижением почечного клиренса необходимо увеличить интервал между введениями препаратов [49]. Хотя фентанил преимущественно метаболизируется в печени и, как полагают, не обладает активными метаболитами, его клиренс снижается при тяжелой уремии [49].
Элиминация и активность ингаляционных анестетиков не зависят от функции почек и скорости клубочковой фильтрации [50]. В результате печеночного метаболизма энфлюрана и севофлюрана теоретически могут образовываться нефротоксичные ионизированные соединения фтора. Использование этих препаратов должно быть кратковременным [50]. Изофлюран менее подвержен метаболизму с образованием ионов фтора. При гипоксии печени метаболизм галотана также ведет к образованию ионов фтора; тем не менее его использование у пациентов с заболеваниями почек не сопровождается какими-либо специфичными осложнениями. По сравнению с прочими ингаляционными анестетиками галотан отличается выраженными кардиодепресивными свойствами и чаще вызывает аритмии. В связи с этим использование препарата у больных с ХБП и поражением сердца требует пристального наблюдения за состоянием сердечно-сосудистой системы [50].
Закись азота не оказывает значительного влияния на функцию почек [47].
Среди миорелаксантов препаратами выбора, несомненно, являются атракуриум и цисатракуриум [51]. Около 90% данных препаратов метаболизируется путем эфирного гидролиза и элиминации Гофмана. Считается, что активность холинэстеразы плазмы не зависит от скорости клубочковой фильтрации, в связи с чем могут также использоваться мивакуриум и суксаметониум (если нет гиперкалиемии) [51]. Приемлемой альтернативой можно считать использование векурониума и рокурониума в ограниченных дозах. Ацидоз удлиняет действие всех миорелаксантов. Экскреция антихолинэстеразных и антихолинергических агентов будет замедлена, поскольку они относятся к высокоионизированным и водорастворимым соединениям.
Местные анестетики особенно ценны как препараты для купирования послеоперационных болей у пациентов с ХБП, но продолжительность их действия снижается на фоне ацидоза. Максимальные дозы местных анестетиков должны быть снижены на 25% в связи с уменьшением связывания с белками и снижением судорожного порога ЦНС [51, 52].
Таким образом, риски анестезии у пациентов с ХБП связаны в основном с потенциальной клинической передозировкой препаратов или с отрицательным действием на почки анестетиков и/или их метаболитов. Рекомендации по изменению доз некоторых анестетиков приведены в табл. 4.  Таблица 4. Особенности дозирования анальгетиков при ХБП Таблица 5. Безопасность препаратов для анестезии при ХБП Примечание. * — обычно избегают назначения этой группы препаратов.
Таблица 4. Особенности дозирования анальгетиков при ХБП Таблица 5. Безопасность препаратов для анестезии при ХБП Примечание. * — обычно избегают назначения этой группы препаратов.
Данные по относительной «безопасности» препаратов для применения во время анестезии суммированы в табл. 5.
Инфузионная терапия и поддержка гемодинамики
— В интраоперационном периоде для профилактики развития ОПП необходимо поддерживать стабильность гемодинамики [53, 54]. Уровень достоверности (доказательности) A. Уровень убедительности рекомендации I.
Гипоперфузия и гемодинамическая нестабильность являются основной причиной развития периоперационного ОПП. Мультицентровые рандомизированные исследования показали, что периоперационная оптимизация гемодинамики уменьшает частоту развития ОПП [53, 54]. Исследование, проведенное среди 33 300 пациентов, не страдающих сердечной недостаточностью, обнаружило, что снижение среднего артериального давления ниже 55 мм рт.ст. в течение 15 мин коррелировало с развитием ОПП в послеоперационном периоде [55]. В другом когортном исследовании, проведенном на 5127 пациентах, которым выполнялись некардиальные операции, риск ОПП увеличивался, если среднее артериальное давление было меньше 60 мм рт.ст. в течение более 20 мин или ниже 55 мм рт.ст. в течение более 10 мин [56]. Эти данные подчеркивают, что даже короткие периоды гипотензии влияют на почки.
— Рекомендуется контролируемая инфузионная терапия в случае дегидратации, при которой, однако, следует избегать перегрузки жидкостью [57]. Уровень достоверности (доказательности) A. Уровень убедительности рекомендации I.
Своевременная коррекция гиповолемии восстанавливает перфузию почек и уменьшает тем самым нефротоксичность [58, 59]. Однако чрезмерная волемическая нагрузка также может способствовать развитию ОПП, увеличивая почечный интерстициальный отек и почечное паренхиматозное давление [60, 61].
— Не рекомендуется использовать гидроксиэтилкрахмалы в связи с риском развития ОПП [62, 63]. Уровень достоверности (доказательности) A. Уровень убедительности рекомендации I.
— Предлагается не использовать желатины и декстраны для инфузионной терапии [64]. Уровень достоверности (доказательности) A. Качество доказательств и сила рекомендации I.
— При предполагаемой необходимости использования коллоидов предлагается инфузия альбумина [65]. Уровень достоверности (доказательности) C. Уровень убедительности рекомендации I.
— Предлагается использовать сбалансированные кристаллоидные растворы при высокообъемной инфузионной терапии [66]. Уровень достоверности (доказательности) C. Уровень убедительности рекомендации I.
Коллоиды могут вызвать гиперонкотическое нарушение клубочковой фильтрации и осмотический нефроз [67]. Данный эффект наиболее выражен у гидроксиэтилкрахмалов и декстранов [68], в меньшей степени — у желатинов [64].
Применение альбумина не имеет отрицательных эффектов на функцию почек, является безопасным, увеличивает ответ на диуретики у пациентов с гипоальбуминемией [69, 70].
Проведенные исследования [71, 72] показывают увеличение риска ОПП и необходимости в проведении ЗПТ, связанной с использованием больших объемов физиологического раствора (0,9% NaCl) по сравнению с сбалансированными кристаллоидными растворами, в которых хлорид частично заменен другим метаболизируемым анионом.
— При необходимости введения вазопрессоров для устранения гипотензии рекомендуется норадреналин (вместе с коррекцией гиповолемии) как вазопрессор первого ряда для защиты почечной функции [73]. Уровень достоверности (доказательности) В. Уровень убедительности рекомендации I.
Согласно результатам исследования D. De Backer и соавт. [73], частота возникновения потребности в проведении ЗПТ была ниже у пациентов, у которых в качестве вазопрессора использовался норадреналин, а не допамин.
Ведение в послеоперационном периоде
— В послеоперационном периоде необходимо избегать перегрузки пациента жидкостью и контролировать кумулятивный водный баланс [74]. Уровень достоверности (доказательности) В. Уровень убедительности рекомендации I.
Перегрузка жидкостью, как было показано в исследовании N. Wang и соавт. [74], является фактором риска повреждения почек в послеоперационном периоде. Кумулятивный баланс жидкости был значительно больше у пациентов с послеоперационным ОПП и являлся независимым фактором риска его развития. У умерших пациентов с ОПП был более высокий кумулятивный баланс жидкости в первые 3 послеоперационных дня, чем у выживших. Многофакторный анализ показал, что кумулятивный баланс жидкости в первые 3 дня после хирургического вмешательства является независимым фактором риска 28-дневной смертности.
— При наличии признаков гиперволемии и ОПП с олигурией/анурией показано применение петлевых диуретиков с целью восстановления диуреза [75, 76]. Уровень достоверности (доказательности) C. Уровень убедительности рекомендации I.
Перед применением диуретиков необходимо убедиться в том, что ОПП не связано с тромбозом почечных вен или артерий. Введение петлевых диуретиков начинают с тестовой дозы в виде болюса фуросемида в/в 40 или 80 мг. По результатам теста далее применяют инфузию фуросемида соответственно 10 или 20 мг/ч под контролем почасового диуреза. Применение фуросемида в дозах более 400 мг/сут не оправдано [20]. Отсутствие эффекта в течение 4 ч является показанием для начала ЗПТ [20].
— При отсутствии признаков гиперволемии от применения диуретиков у пациентов с ОПП и ХБП следует воздержаться [75, 76]. Уровень достоверности (доказательности) C. Уровень убедительности рекомендации I.
Применение петлевых диуретиков в ряде случаев может вызывать неблагоприятные эффекты. Так, их использование при постренальном ОПП до восстановления оттока мочи будет способствовать развитию гидронефроза и усугубит течение ОПП. Учитывая механизм действия фуросемида, его введение в условиях гиповолемии усилит гипоперфузию почек за счет снижения ударного объема левого желудочка.
При ОПП фуросемид не снижает необходимости в ЗПТ, а также внутригоспитальную смертность при его назначении с профилактической или лечебной целью пациентам с риском или уже возникшей ОПП [77].
— Не рекомендуется использовать допамин в так называемой «почечной» дозе (менее 3 мкг/кг/мин) для профилактики и лечения ОПП [78]. Уровень достоверности (доказательности) A. Уровень убедительности рекомендации I.
Допамин не обладает нефропротективными свойствами, поэтому его применение в группах высокого риска развития ОПП не оказывает профилактического эффекта и ограничено непосредственно основными показаниями [20].
Применение «почечных» доз допамина в клинических исследованиях не подтвердило их ренопротективный эффект, описанный в эксперименте на животных. Кроме того, даже низкие дозы допамина способны провоцировать нарушения сердечного ритма, особенно при часто встречающихся при ОПП дизэлектролитемии и метаболическом ацидозе [78].
— У пациентов с риском ОПП, а также при лечении пациентов с уже развившимся ОПП необходимо проводить инсулинотерапию, направленную на поддержание целевого уровня глюкозы плазмы крови: 6,1—8,3 ммоль/л [79]. Уровень достоверности (доказательности) C. Уровень убедительности рекомендации I.
В различных исследованиях было показано, что строгий гликемический контроль позволяет снизить частоту и тяжесть ОПП. Так, M. Schetz и соавт. [80] представили данные, что контроль гликемии привел к снижению частоты развития тяжелого ОПП с 7,65 до 4,5% (p=0,0006) в группе из 2707 больных. Потребность в ЗПТ не снизилась в общей группе, но была при этом достоверно ниже у хирургических больных (4% против 7,4%; p=0,008).
Развитие ОПП часто сопровождается формированием белково-энергетической недостаточности, значимо увеличивающей показатели смертности [81]. Избыточное поступление белка при ОПП может способствовать усугублению метаболического ацидоза и азотемии и привести к необходимости проведения ЗПТ. Таким образом, потребление белка более 2 г/кг/сут и менее 0,8 г/кг/сут нецелесообразно. Рекомендуется назначать 0,8—1,0 г/кг/сут белка пациентам с ОПП без признаков гиперкатаболизма и/или не нуждающимся в ЗПТ; 1,0—1,5 г/кг/сут пациентам с ОПП, получающим ЗПТ. Поступление энергии должно обеспечиваться за счет углеводов из расчета 3—5 (максимум 7) г/кг массы тела и жиров в количестве 0,8—1,0 г/кг массы тела. У пациентов с ОПП рекомендуется осуществлять преимущественно энтеральное питание и прибегать к парентеральному лишь по мере необходимости [20].
Антикоагулянт выбора для проведения послеоперационной тромбопрофилактики у пациентов с ОПП и ХБП — нефракционированный гепарин, так как при его применении не наблюдается кумулятивного эффекта [82, 83].
Низкомолекулярные гепарины (НМГ) в значительной степени элиминируются почечным механизмом, поэтому на фоне снижения клиренса креатинина увеличивается время полувыведения этих препаратов. В приложении Г8 представлены рекомендации по коррекции дозы НМГ у пациентов с почечной недостаточностью [82, 83].
Нефротоксические препараты в периоперационном периоде
Около 20% случаев госпитального ОПП вызваны лекарственными препаратами. Среди пациентов пожилого возраста частота медикаментозной нефротоксичности достигает 66% [
Источник
Причины и симптомы острой почечной недостаточности у кошек и собак и др. Методы диагностики почечной недостаточности. Способы лечения ОПН
Острая почечная недостаточность (ОПН, Acute Renal Failure, АFR)
Острая почечная недостаточность – одна из тяжелейших патологий, встречающаяся в повседневной практике ветеринарного доктора.
Острая почечная недостаточность – нефрологический синдром, характеризующийся внезапным или быстро наступившим снижением экскреторной функции почек с нарушением гомеостаза организма.
Острое повреждение почек (ОПП) это наличие функциональных и структурных изменений, или признаков почечного повреждения, включая изменения в крови, моче, биоптате, или результатах визуализации в период менее трех месяцев.
Чем острая почечная недостаточность отличается от хронической почечной недостаточности
Главное различие с хронической почечной недостаточностью (ХПН) – это потенциальная обратимость и полное, реже частичное, восстановление всех парциальных функций почек.
При ОПН морфологически определяется распространенный некроз эпителия почечных канальцев. Выраженность морфологических изменений бывает различной. В некоторых случаях изменения канальцевого эпителия происходят без нарушения целостности канальцевой базальной мембраны (тубулонекроз), в наиболее тяжелых ситуациях она частично разрушается (тубулорексис). Обратимость ОПН объясняется способностью к регенерации эпителия почечных канальцев, которая начинается с 4-5-го дня анурии. Исходя из вышесказанного, стоит остановиться на функциональном устройстве почки.
Почка собаки
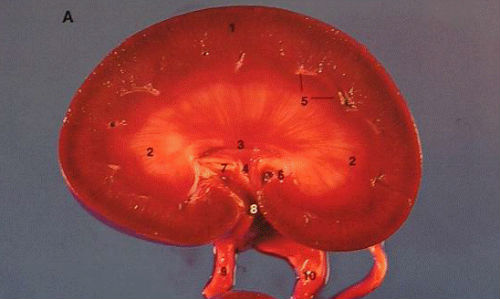
- Корковое вещество с лучами мозгового вещества.
- Мозговое вещество.
- Гребень
- Почечная лоханка
- Междольковые артерии и вены.
- Почечная пазуха.
- Жировые отложения.
- Ворота.
- Почечная артерия.
- Мочеточник
СТРОЕНИЕ НЕФРОНА
Основной структурно-функциональной единицей почки является нефрон. В обеих почках у собак в норме насчитывается примерно 186 000-373 000 нефронов, у кошек в каждой почке 200 000-500 000 нефронов. Каждый нефрон состоит из почечного, или мальпигиева, тельца и канальца. Почечное тельце является начальной частью нефрона и состоит из клубочка и покрывающей его капсулы (капсула Шумлянского-Боумена). Клубочек представляет собой сосудистое образование, состоящее из капиллярных петель, начинающихся от приносящей клубочковой и собирающихся в выносящую клубочковую артериолу.
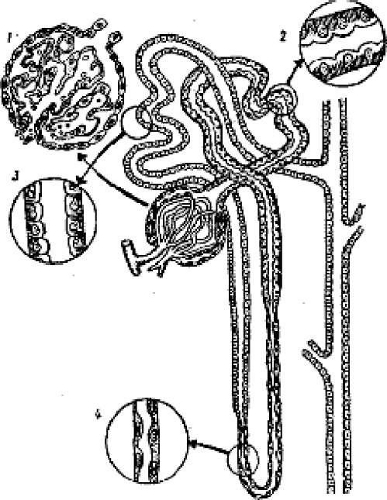
Строение нефрона:
1 – клубочек; 2 – проксимальный отдел канальца; 3 – дистальный отдел канальца; 4 – тонкий отдел петли Генле/
Капсула Шумлянского—Боумена в разрезе имеет форму чаши, внутри которой расположен клубочек. Она состоит из двух листков (слоев) — внутреннего и наружного. Полость клубочковой капсулы непосредственно переходит в просвет, а наружный листок капсулы — в стенку канальца. Приносящая и выносящая артериолы клубочка образуют его полюс, располагаются рядом и не покрыты капсулой Шумлянского—Боумена. Клубочковые капилляры как бы подвешены к этому полюсу.

Схематическое изображение мальпигиева тельца:
1 – приносящая клубочковая артериола; 2 – выносящая клубочковая артериола; 3 – капиллярные петли клубочка; 4 – капсула; 5 – каналец.
Виды ОПН
- Преренальная (шоковая или гиповолемическая).
- Ренальная (нефротоксичная, воспалительная).
- Постренальная (обструктивная).
Известно, что и преренальная, и постренальная формы в процессе развития обязательно трансформируются в ренальную форму ОПН. Таким образом, ранняя диагностика, знание этиологии пре- и постренальных форм ОПН позволяет с помощью своевременного вмешательства предотвратить тяжелые поражения почек.
Главными причинами возникновения преренальной ОПН являются: септический шок и кардиогенный шок (снижение сердечного выброса, эмболия легочной артерии).
Резкое уменьшение объема циркулирующей крови (кровотечение, потеря воды и электролитов и т.д.). Системная вазодилятация (сепсис, анафилаксия, антигипертензивные препараты, гепаторенальный синдром). Внутрисосудистый гемолиз (кровепаразитарные и аутоиммунные заболевания).
Причинами ренальной ОПН могут быть следующие заболевания: поражение внутрипочечных сосудов (тромбоз, эмболия, васкулит, спазмы приводящей артериолы при передозировке ингибиторов АПФ и нестероидных противовоспалительных препататов), гломерулярные воспаления (пролиферативные гломерулонефриты (ГН), быстро прогрессирующие ГН, острый тубулоинтерстициальный нефрит, острый нефротоксический канальцевый некроз.
К причинам постренальной ОПН относят нарушения оттока мочи различного генеза (закупорка мочеточника, уретры камнем, опухолью, острая задержка мочи вследствие острого цистита у котов или конкрементов в мочевом пузыре, опухоли мочевого пузыря).
Самыми распространенными причинами острой почечной недостаточности являются внутрипочечные процессы. Среди них преобладает острый некроз канальцев (ОНК).
Зона распределения некроза клеток канальца при ишемической и токсической острой почечной недостаточности (выделено черным цветом).
Участок PST наиболее чувствителен к ишемии и токсическому действию тяжелых металлов. Участок PCT наиболее подвержен действию аминогликозидов.
Стадии острой почечной недостаточности
Выделяют четыре периода:
- период действия этиологического фактора;
- период олигурии – анурии, при котором суточный диурез у собак может доходить до 0-2 мл. мочи кг/ч.;
- период восстановления диуреза с фазой начального диуреза и с фазой полиурии (количество мочи увеличивается), длительность до 75 дней;
- период выздоровления, начинающийся с момента нормализации азотемии, он может затягиваться от 3-6 месяцев до 1-2 лет.
Клиническая картина у собак и кошек проявляется быстрым развитием и стабильно сохраняющимися симптомами (рвота , отсутствие аппетита, апатия). Отмечается болезненность почек. В случае стадии анурии развивается снижение выработки мочи, несмотря на проводмые инфузии растворов. К неспецифическим признаком относят частое дыхание, при котором организм пытается компенсировать изменения в организме на фоне снижающейся выделительной функции почек.
Диагностика острой почечной недостаточности
Анализ крови. Клинический и биохимический анализ крови: отмечается увеличение уровня остаточного азота крови (креатинин, мочевина). При постренальном и ренальном остром поражении почек развивается гиперкалиемия. Отмечается рост фосфора.
Если при проведении серийных исследований крови, отмечают повышение уровня креатинина, мочевины и фосфора, то такое состояние говорит о прогрессирующем ухудшении функции почек и не эффективности проводимого лечения.
Анализ мочи
Мочевой осадок – при преренальной ОПН анализ мочи не изменен, за исключением цилиндрурии.
Наличие эритроцитов в сочетании с высоким содержанием белка в мочеой протеинурией характерно для ГН.
Лейкоцитарные цилиндры и эозинофилы в моче характерны для интерстициального нефрита, в том числе лекарственного происхождения.
Появление почечных цилиндров характерно для острого канальцевого некроза.
Визуальные методы исследования
Ультразвуковое и рентгенолочическое исследования, позволяют оценить степень изменений органов мочевой системы и выявить причины постренальной ОПН.
Лечение острой почечной недостаточности у кошек и собак
При поступлении животного в клинику с подозрением на развитие ОПН необходимо как можно скорее приступать к диагностическим и лечебным мероприятиям исходя из стадий развития болезни.
Тактика лечения складывается из лечения и устранения причин, приведших к развитию ОПН, предотвращения и уменьшения повреждения почек, коррекции состояния в период почечной недостаточности и в фазу восстановления функции почек.
В случае неэффективности консервативной терапии необходио рассмотреть вариант проведения диализа. Допустимо проведение перитониального диализа или гемодиализа.
Источник


