Оглавление
- 1 Хламидиоз
- 2 Микоплазмоз
- 3 Хламидиоз у собак
- 3.0.1 Клинические проявления хламидийной и микоплазменной инфекции в оториноларингологии
- 3.0.2 Особенности течения заболеваний носа и околоносовых пазух у пациентов с микоплазменной и хламидийной инфекцией
- 3.0.3 Особенности течения заболеваний глотки и гортани у пациентов с микоплазменной и хламидийной инфекцией
- 3.0.4 Особенности течения заболеваний уха у пациентов с микоплазменной и хламидийной инфекцией
- 3.0.5 Методы диагностики хламидийной и микоплазменной инфекции
- 3.0.6 Особенности антибактериальной терапии хламидийной и микоплазменной инфекции
- 4 Побочные действия
- 5 Часто возникающие вопросы
Хламидиоз – одна из самых распространенных инфекций, передаваемых половым путем (ИППП), вызываемая хламидиями (Chlamydia trachomatis). По статистике, у более чем 10% сексуально активных людей выявляется хламидиоз.
Хламидиоз
Хламидиоз – одна из самых распространенных инфекций, передаваемых половым путем (ИППП), вызываемая хламидиями (Chlamydia trachomatis). По статистике, у более чем 10% сексуально активных людей выявляется хламидиоз (это, в 2-3 раза чаще, чем, например, заболеваемость гонореей).
Из-за скрытого течения инфекции заболевание приобретает хроническое течение и поражает различные другие органы. Так, у пациентов с хламидиозом могут развиться конъюнктивит, пневмония, артрит хламидийной природы. Хламидиоз становится и основной причиной уретритов, простатитов, цервицитов, бесплодия. Хламидиоз у женщин может привести к невынашиванию беременности (выкидышу), патологии развития плода.



В России хламидиозом ежегодно заболевают порядка 1,5 миллиона человек. Опасность хламидиоза заключается в том, что у 75% женщин и 50% мужчин типичные признаки хламидиоза отсутствуют, и человек достаточно продолжительное время может не знать о том, что болен хламидиозом.
Урогенитальный хламидиоз вызывается хламидией, которая имеет свойства бактерии и вируса. Подобно вирусу, хламидия живет внутри клетки, а по своему строению она напоминает бактерию. У хламидии имеются 2 жизненных цикла: инфекционная стадия (когда она живет вне клетки) и ретикулярная стадия (когда она обитает в клетке, как паразит).
У хламидиоза инкубационный период длится от 1 до 6 недель. Хламидии редко встречаются изолированно, чаще всего им сопутствуют гонококки, трихомонады, мико-и уреаплазмы, цитомегаловирус, вирус герпеса и папилломы человека.
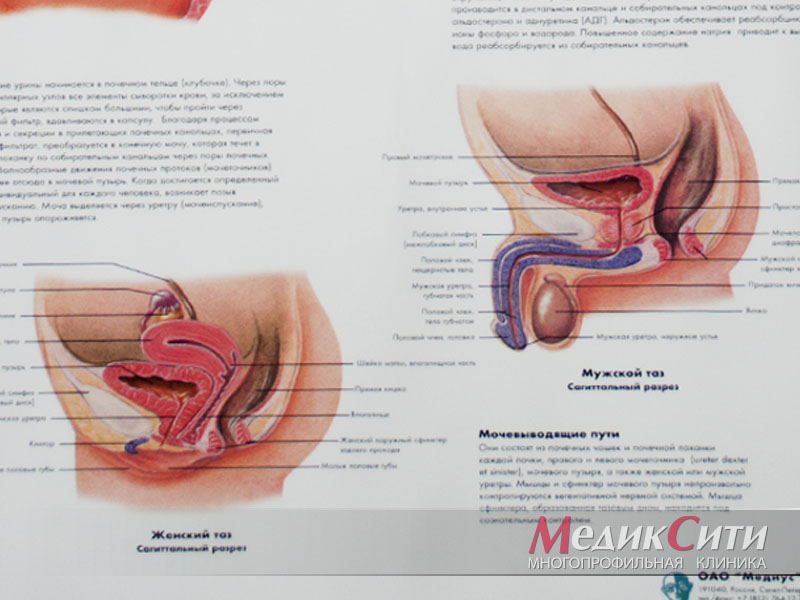
Уреаплазмоз, микоплазмоз могут вызвать воспалительные заболевания матки и придатков, бесплодие самопроизвольные аборты и преждевременные роды у женщин, уретрит, простатит у мужчин, цистит у обоих партнеров.
Микоплазмоз
Микоплазма – одноклеточный микроорганизм, занимающий промежуточное положение между грибами, вирусами и бактериями. У клеточной мембраны микоплазмы нет жесткой клеточной оболочки, вместо нее имеется очень тонкая пленка – плазмалемма. При помощи этой пленки микроорганизм приклеивается к клеткам хозяина и начинает паразитировать за его счет. Размер микоплазмы от 0,2 до 0,8 мкм, поэтому его не чувствуют защитные барьеры организма. Попав на слизистые оболочки, микоплазма начинает вызывать воспаление в клетках и усиливает развитие аутоимунных процессов.
Симптомы микоплазмоза
Урогенитальный микоплазмоз (вызванный Mycoplasma genitalium), может быть обнаружен как у мужчин, так и у женщин. В целом при микоплазмозе симптомы схожи с признаками воспалительных заболеваний мочеполовой системы (вагинит, эндометрит, цистит, уретрит, пиелонефрит и др.). Больные жалуются на зуд и жжение в половых органах, учащенное мочеиспускание. У мужчин после отхода мочи наблюдается жжение и боль в уретре, так как поражаются близлежащие к уретре ткани. У женщин после полового контакта возникает сильная боль внизу живота. Симптомы появляются примерно через 10 дней после заражения микоплазмой гениталиум.
Однако нередки случая бессимптомного протекания микоплазмоза.
Лечение микоплазмоза
Лечение этого заболевания – достаточно трудный процесс, требующих комплексных мер. Наибольшее действие оказывает лечение антибактериальными препаратами. Хорошей эффект дает использование экстракорпоральной антибактериальной терапии (плазмафереза).
Назначаются противогрибковые и противопротозойные препараты, физиотерапевтическое лечение и промывание мочевоиспускательного канала лекарственными средствами. Курс лечения -10 дней, затем проводится бакпосев.
Лечение микоплазмоза в МедикСити
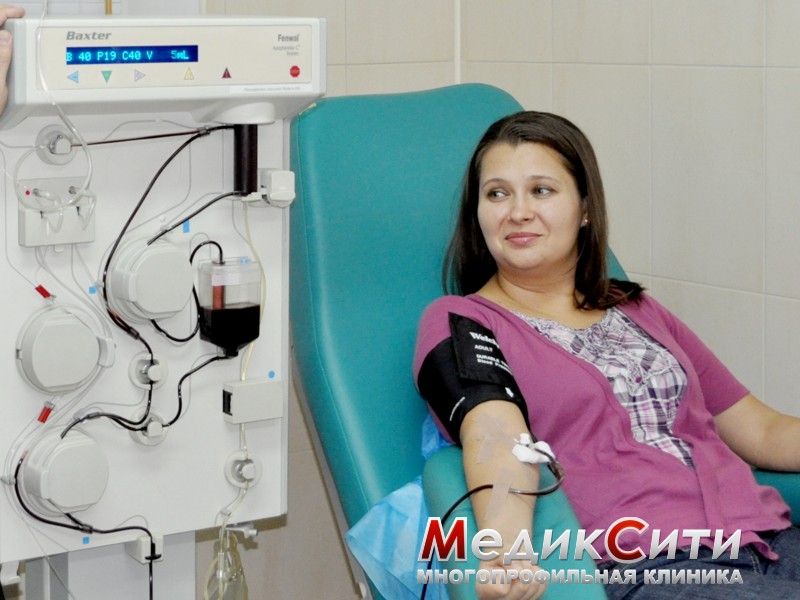
Плазмаферез при лечении микоплазмоза

Плазмаферез при лечении микоплазмоза
Цель исследования — проанализировать клинические проявления, методы диагностики и лечения хламидийной и микоплазменной инфекции ЛОР-органов. На основании результатов исследований, представленных в отечественной и иностранной литературе, обоснована целесообразность дальнейшего изучения клинических проявлений хламидийной и микоплазменной инфекции в оториноларингологии.
Хламидиоз у собак
Кафедра оториноларингологии РНИМУ им. Н.И. Пирогова Минздравсоцразвития России, Москва
Кафедра оториноларингологии лечебного факультета Российского национального исследовательского медицинского университета им. Н.И. Пирогова, Москва
Хламидийная и микоплазменная инфекция в оториноларингологии (систематический обзор)
Журнал: Вестник оториноларингологии. 2012;77(6): 91-97
Пальчун В. Т., Гуров А. В., Руденко В. В. Хламидийная и микоплазменная инфекция в оториноларингологии (систематический обзор). Вестник оториноларингологии. 2012;77(6):91-97.





Цель исследования — проанализировать клинические проявления, методы диагностики и лечения хламидийной и микоплазменной инфекции ЛОР-органов. На основании результатов исследований, представленных в отечественной и иностранной литературе, обоснована целесообразность дальнейшего изучения клинических проявлений хламидийной и микоплазменной инфекции в оториноларингологии.
Кафедра оториноларингологии РНИМУ им. Н.И. Пирогова Минздравсоцразвития России, Москва
Кафедра оториноларингологии лечебного факультета Российского национального исследовательского медицинского университета им. Н.И. Пирогова, Москва
В последние годы с появлением новых, современных методов диагностики инфекционных заболеваний появилась возможность всестороннего изучения характера микрофлоры, вызывающей гнойно-воспалительные заболевания ЛОР-органов, включая атипичные патогены и в первую очередь хламидии и микоплазмы. К настоящему времени получены достаточно убедительные данные, свидетельствующие о том, что сочетание внутриклеточной инфекции с традиционной бактериальной микрофлорой зачастую создает максимально благоприятные условия для становления и хронизации таких заболеваний, как синусит, фарингит, средний отит.
Хламидии и микоплазмы — это микроорганизмы, отчасти сходные по своим свойствам. При этом хламидии являются облигатными внутриклеточными паразитами, жизненный цикл которых связан с непосредственным нахождением в клетках хозяина, в то время как микоплазмы, ввиду особенностей их жизнедеятельности, персистируют на мембранах клеток макроорганизма и, таким образом, являются облигатными мембранными паразитами человека.
Микоплазмы — мембранные паразиты, лишенные клеточной стенки прокариоты, обитают чаще всего на слизистой оболочке дыхательных путей и урогенитального тракта [1].
По современной классификации все прокариотические организмы объединены в два домена: Archae и Васteria. Микоплазмы принадлежат к филуму Mollicutes, входящему в домен Васteria. Молликуты — класс мелких прокариотических организмов, основной отличительной особенностью которых является отсутствие клеточной стенки. Вместо нее имеется прочная мембрана, основным структурным компонентом являются липидные соединения, в частности холестерин.
Таксономия класса Mollicutes: порядок — Mycoplasmatales, семейство — Mycoplasmataceae, род — Mycoplasma, включающий в себя 107 видов, и род Ureaplasma, включающий в себя 7 видов [2].
У человека наиболее часто встречаются следующие виды рода Mycoplasma: M. pneumoniae, M. hominis, M. buccale, M. fermetans, М. genitalium, M. lipophilum, M. orale, M. faucium, M. salivarium и рода Ureaplasma — U. urealyticum [3].
Наибольшее значение для патологии респираторного тракта и уха имеют M. pneumoniae, М. hominis, М. genitalium, M. fermentans.
Хламидии — грамотрицательные облигатные внутриклеточные паразиты, способны размножаться только внутри клетки хозяина, обладают тропизмом к цилиндрическому эпителию, могут длительно персистировать в организме, а именно в макрофагах, что характерно для хронических воспалительных процессов.
Хламидии имеют сложную антигенную структуру. Родоспецифический антиген, локализующийся на наружной мембране клеточной стенки, представлен липополисахаридом (LPS), характерным для всех грамотрицательных бактерий [4].
Хламидии имеют сложный цикл развития: ретикулярное тельце (РТ), промежуточное тельце (ПТ), элементарное тельце (ЭТ). ЭТ хламидий фагоцитируются чувствительными клетками, но обычно не лизируются, а трансформируются в ПТ, а затем в РТ. Последние производят новые ЭТ. Внутриклеточный цикл развития хламидий продолжается 2—3 сут, после чего большинство инфицированных клеток разрушается и в межклеточные пространства попадает множество новообразованных ЭТ и РТ. Вследствие этого инфицируются новые клетки и патологический процесс вновь продолжается [5].
Таксономия порядка Chlamydiales включает в себя следующие семейства: Chlamydiaсeae, Simkaniaceae, Parachlamydiaceae, Waddliaceae. Семейство Chlamydiaсeae, включает в себя род Chlamydia и род Chlamydophila. Видовые представители рода Chlamydia: С. trachomatis, C.suis, C. muridarum. Видовые представители рода Chlamydophila: C. pneumoniae, C. psittaci, C. pecorum, C. abortus, С. caviae, C. felis. Семейство Simkaniaceae состоит из рода Simkania, включающего вид S.negevensis. Семейство Parachlamydiaceae состоит из рода Parachlamydia, включающего вид P. acanthamoebae. Семейство Waddliaceae состоит из рода Waddlia, включающего вид W. сhondrophila [6].
Наибольшее значение для патологии дыхательных путей имеют C. pneumoniaе, C. trachomatis. Поражение верхних дыхательных путей при инфицировании C. рsittaci наблюдается крайне редко, так как интенсивное первичное размножение возбудителя происходит в альвеолярном эпителии бронхов [7].
Клинические проявления хламидийной и микоплазменной инфекции в оториноларингологии
Сведения, касающиеся этиологической и патогенетической роли хламидий и микоплазм, а также их ассоциаций с типичными бактериальными патогенами при патологии ЛОР-органов, носят неоднозначный и противоречивый характер [8].
При инфицировании человека M. pneumoniae или C. pneumoniae могут поражаться различные органы и системы. Описаны разнообразные клинические варианты: от легкого течения с симптоматикой ринита, назофарингита, трахеита, бронхита до тяжелых пневмоний, сопровождающихся различными респираторными осложнениями [9]. Возникающее поражение верхних дыхательных путей хламидийной и микоплазменной этиологии часто характеризуется признаками системного поражения респираторного тракта, включая и его нижние отделы. Микоплазменная инфекция протекает легче, чем хламидийная инфекция, возможны бессимптомные формы, определяемые только методом сероконверсии [10]. Среди симптомов при микоплазменном поражении наиболее часто встречается затруднение носового дыхания, незначительные или умеренные слизисто-серозные или слизисто-гнойные выделения из носа, симптомы фарингита и ларингита.
При инфицировании С. pneumoniae может поражаться слизистая оболочка верхних отделов респираторного тракта, глотки, околоносовых пазух с возможной генерализацией, развитием симптомов интоксикации и поражением сосудов [5]. При этом характерно подострое развитие заболевания с ознобом и лихорадкой, быстро появляющимся продуктивным кашлем с гнойной мокротой. Наряду с кашлем у больных наблюдаются умеренные признаки поражения верхних дыхательных путей — ринит, фарингит, ларингит. Явления ринита, по данным Г.Г. Мусалимовой и соавт. [11], при хламидийной пневмонии встречаются чаще, чем при микоплазменной. При этом у больных наблюдаются серозные или серозно-гнойные выделения из носа.
По данным И.А. Ивановой, С.И. Казаковой [12], М.С. Савенковой [13], основными клиническими проявлениями острых респираторных заболеваний хламидийной этиологии являются затяжной кашель, лимфоаденопатия, умеренно выраженные катаральные явления, проявляющиеся гиперемией и зернистостью задней стенки глотки, отделяемое из носа по утрам на фоне нормальной или субфебрильной температуры.
И.М. Виницкая [14] описывает полипозные изменения слизистой оболочки носа и субатрофические изменения слизистой оболочки глотки при хроническом поражении. Хламидийная инфекция в этом случае выявлялась в 15—16% случаев.
Данные о частоте встречаемости хламидийной инфекции при воспалительной патологии глотки, носа, околоносовых пазух существенно варьируют и составляют от 7 до 74,4% в зависимости от нозологической формы заболевания [15]. Такая вариабельность показателей распространенности хламидийной инфекции при заболеваниях ЛОР-органов обусловлена применением разнообразных методов выявления данных микроорганизмов, различной организацией проводимых исследований, отсутствием стандартизированного метода забора клинического материала.
Особенности течения заболеваний носа и околоносовых пазух у пациентов с микоплазменной и хламидийной инфекцией
По данным М.А. Лихановой [16], при осмотре пациентов с полипозным риносинуситом в сочетании с атипичной флорой имелись выраженный отек слизистой оболочки носа и слизистое отделяемое в полости носа, а также изменялся цвет слизистой оболочки, имелась неравномерность ее окраски и цианотичный, застойный оттенок в большем проценте случаев по сравнению с полипозным риносинуситом без атипичной флоры. Помимо этого, у больных с хламидийным поражением слизистой оболочки носа и околоносовых пазух выявлено преобладание полипов с воспалительной инфильтрацией и переходноклеточной метаплазией.
По данным О.В. Париловой [17], комплексное лабораторное исследование позволило обнаружить высокие показатели частоты выявления хламидийного инфицирования слизистой оболочки носа. Наиболее часто хламидии идентифицировались у лиц с острым гайморитом и хроническим гипертрофическим ринитом: соответственно в 40,0 и 40,7%. Несколько реже хламидийная инфекция верифицировала у пациентов с обострением хронического гайморита — в 30,8% случаев. Тот же автор сообщает, что у инфицированных хламидиями больных значительно чаще (в 1,7—3,3 раза в зависимости от нозологической формы) диагностировалась C. pneumoniaе, которая выявлялась у лиц с острым гайморитом, обострением хронического гайморита и хроническим гипертрофическим ринитом. У трети инфицированных больных с острым гайморитом, у 7,2—8,3% пациентов с хроническим синуситом и ринитом в слизистой оболочке носа выявлялись маркеры как C. pneumoniaе, так и С. trachomatis.
Ю.В. Лобзин и соавт. [5] установили, что острый рецидивирующий синусит, обусловленный персистенцией C. trachomatis, чаще всего сопровождается хроническим воспалением небных миндалин и глотки, вызванным инфицированием этим же возбудителем. Хронический синусит в большинстве случаев сочетался с параллельным инфицированием глотки C. pneumoniae. Помимо этого, для острого синусита, вызванного C. pneumoniae, характерно развитие острого отита, связанного с тем же возбудителем, а также вовлечение в воспалительный процесс остальных околоносовых пазух с развитием как острого, так и хронического полисинусита. В то же время для C. trachomatis на фоне урогенитального поражения более характерно изолированное вовлечение в процесс верхнечелюстных пазух. C. psittaci при воспалительных заболеваниях ЛОР-органов встречается только в составе микст-хламидийной инфекции, чаще всего в сочетании с C. pneumoniae у больных полисинуситом.
А.Ю. Овчинников и И.Г. Колбанова [18], описывая риносинусит хламидийной и микоплазменной этиологии у больных в сочетании с острой или хронической патологией нижних дыхательных путей, отметили, что риносинусит хламидийной этиологии проявлялся заложенностью носа, нарушением носового дыхания, умеренными слизисто-серозными выделениями из носа. В анамнезе у всех больных были неоднократные курсы пункционного лечения верхнечелюстных пазух и умеренный лейкоцитоз в крови с незначительным увеличением СОЭ. Для микоплазменной инфекции были более характерны слизисто-гнойные выделения из носа. При сопоставлении формы гайморита и частоты встречаемости атипичной микрофлоры было установлено, что M. pneumoniae более часто выделяется при остром синусите, а C. pneumoniaе — у больных с обострением хронического риносинусита.
Хронический синусит может также развиваться как осложнение офтальмохламидиоза вследствие распространения инфекции по носослезному каналу. У 75,5% больных с офтальмохламидиозом диагностируется хронический ринофарингит хламидийной этиологии, при генерализованных формах хламидийной инфекции в 21,4% преобладает клиника хронического фарингита и в 24,5% — хронического тонзиллита [19]. B. Goh и соавт. [20] в 2006 г. описали 4 случая острого среднего отита, ассоциированного с конъюнктивитом хламидийной этиологии.
Ю.В. Лобзин и соавт. [5] установили, что при остром синусите хламидийной этиологии больные чаще жалуются на затруднение носового дыхания, необильное густое слизистое отделяемое из носа. При рентгенологическом обследовании имелось пристеночное утолщение слизистой оболочки верхнечелюстных пазух. При хроническом синусите хламидийной этиологии у 52,4% пациентов отмечено гнойное воспаление, а у 47,6% пациентов — полипозно-гнойное поражение околоносовых пазух. При выполнении рентгенологического исследования чаще выявляли уровень жидкости в просвете пазух, значительно реже — гиперпластический процесс. Помимо этого, у больных с острым и хроническим воспалением отмечены общая слабость, недомогание, длительный субфебрилитет; продолжительность заболевания обычно составляла от 14 и более дней.
Отмечено, что у пациентов, которым проводилось хирургическое лечение в объеме вскрытия верхнечелюстных пазух с наложением соустья через нижний носовой ход и (или) расширения естественного, в 52,4% случаев синусит рецидивировал через 2 нед после проведенного лечения, у 33,3% — в период от 1 до 6 мес, у 14,3% — более чем через 6 мес. У лиц с хроническим гайморитом хламидийной этиологии отмечены длительные сроки послеоперационной реабилитации, характеризующиеся частыми обострениями синусита и малосимптомным, торпидно протекающим гнойным воспалением [5].
Особенности течения заболеваний глотки и гортани у пациентов с микоплазменной и хламидийной инфекцией
В работе О.В. Ловачевой, И.Ю. Шумской [21] описаны клинические особенности острых респираторных заболеваний, обусловленных персистенцией М. рneumoniae, которые были изучены в естественных условиях и в эксперименте путем инфицирования добровольцев аттенуированными штаммами микоплазм. В большинстве случаев аэрозольное или интраназальное введение культуры М. рneumoniae вызывало у добровольцев через 3—11 дней инкубации клиническую картину острого респираторного заболевания. Характерным было постепенное начало болезни с коротким продромальным периодом, легкое течение с маловыраженными симптомами интоксикации и катарального фарингита и ринофарингита. У больных микоплазмозом картина острого респираторного заболевания характеризовалась той же закономерностью развития клинических симптомов, что и у добровольцев. При легком течении отмечалось катаральное воспаление верхних дыхательных путей в виде фарингита и частое сочетанное поражение верхних и нижних дыхательных путей (ринобронхит, фарингобронхит, ринофарингобронхит). Так, W. Williams и соавт. [22], изучая этиологию острого фарингита у 419 пациентов, выявили M. pneumoniae у 13% больных. Причем у пациентов с микоплазменным поражением чаще отмечалась охриплость и гораздо реже — жалобы на стекание слизи по задней стенке глотки.
D. Dionisio и соавт. [23] описали наблюдение фарингита, полиартрита и локализованной экзантемы у пациента с острой инфекцией, вызванной M. pneumoniae и не затрагивавшей нижние дыхательные пути.
При микоплазменной инфекции глотки выявляются отчетливая, но умеренная гиперемия небных дужек, миндалин, задней стенки глотки, жалобы на боли в горле и длительный непродуктивный кашель. При этом наряду с умеренной гиперемией слизистой оболочки глотки, незначительным увеличением подчелюстных и шейных лимфатических узлов достаточно часто вовлекаются в патологический процесс нижние дыхательные пути [24].
По данным М. Жерман-Фаталь [25], M. pneumoniae наиболее часто встречается у молодых лиц в возрасте от 5 до 19 лет, а 35% здоровых детей являются носителями данного возбудителя, который может вызывать симптомы фарингита и отита.
По данным Е.В. Демченко и соавт. [26], при хламидийном поражении глотки и гортани жалобы больных в момент первого обращения сводились к выраженному першению и болевым ощущениям в горле. Пациенты отмечали дисфонию, характеризующуюся понижением тональности голоса, повышенное выделение слизи и навязчивое покашливание, особенно усиливающееся во время фонации. При фарингоскопии выявляли гиперемию и инфильтрацию слизистой оболочки задней стенки глотки. При ларингоскопическом исследовании также определялась гиперемия и незначительная инфильтрация надгортанника и черпалонадгортанных складок, что в какой-то мере может объяснить присутствие выраженного болевого синдрома у данной категории больных. В межчерпаловидной области наряду с незначительным утолщением слизистой оболочки практически всегда можно обнаружить комки вязкой или пенистой слизи. Голосовые складки при выполнении ларингоскопии характеризовались наличием гиперемии и инфильтрации.
В.И. Линьков и соавт. [27] обнаруживали хламидии при хроническом аденоидите в группе детей от 5 до 15 лет в 44,3% случаев, при хроническом тонзиллите — у 41,7% пациентов с данной патологией. В мазках со слизистой оболочки задней стенки глотки при сочетанном поражении глоточной и небных миндалин хламидии были выявлены в 45%, а в мазках из носа у тех же больных — в 39%.
Особое внимание, по данным А.Б. Туровского и И.Г. Колбановой [28], при сборе анамнеза следует обращать на длительное трахеальное канюленосительство, что является фактором повышенного риска инфицирования хламидиями.
Особенности течения заболеваний уха у пациентов с микоплазменной и хламидийной инфекцией
E. Shanon и соавт. [29] в 1982 г. описали наблюдение острой односторонней нейросенсорной тугоухости у пациента с респираторным микоплазмозом. Уже на 3-й день лечения тетрациклином слух был восстановлен. Авторы обращают внимание на необходимость проведения дополнительных лабораторных исследований для выявления атипичных возбудителей в случае острой нейросенсорной тугоухости, возникшей на фоне инфекции респираторного тракта. В 1996 г. T. Okada и соавт. [30] описали 4 случая развития острой нейросенсорной тугоухости, ассоциированной с респираторным микоплазмозом. Особенность заболевания выражалась в том, что у всех пациентов на раннем этапе течения обычной респираторной инфекции развились кохлеарные симптомы. На фоне проведенной комплексной терапии, включавшей в себя кортикостероидные, сосудистые, а также антибактериальные препараты (кларитромицин), в течение 10 дней удалось добиться полного восстановления слуха у 2 и значительного улучшения слуха у остальных больных.
В 2001 г. B. Schonweiler и соавт. [31] представили наблюдение острой односторонней нейросенсорной тугоухости, развившейся на фоне респираторного микоплазмоза у 10-летнего ребенка. Максимальная потеря слуха достигала 30 дБ. Авторы указывают на возможность причинно-следственной связи между инфекцией, вызванной M. pneumoniae, и внезапной потерей слуха.
Существуют отдельные сообщения, показывающие связь респираторного микоплазмоза с развитием паралича Белла. A. Klar и соавт. [32] в 1985 г. описали случай микоплазменной инфекции у 12-месячного ребенка, протекавшей с явлениями тонзиллита и бронхопневмонии и осложнившейся двусторонним параличом Белла.
В 2004 г. в Германии С. Volter и соавт. [33] провели серологическое исследование крови с целью выявления антител к M. pneumoniae у 91 больного с идиопатическим параличом Белла. Диагноз текущего респираторного микоплазмоза, основанный на серологическом исследовании крови, был выявлен у 24 (26,4%) пациентов. Причем только двое пациентов предъявляли жалобы со стороны органов дыхания. Авторы утверждали, что даже в случае отсутствия симптоматики со стороны дыхательных путей пациенты с идиопатическим параличом Белла должны быть обследованы на наличие микоплазменной инфекции.
Y. Uno [34] приводит данные об обнаружении М. рneumoniae в аспирате, полученном при тимпанотомии у 10-летнего ребенка с экссудативным средним отитом. Проведенное консервативное лечение с применением β-лактамных антибиотиков было не эффективно. Аспират из среднего уха, а также соскоб из носоглотки были исследованы на M. pneumoniae, которая была обнаружена методом ПЦР. Серологическое исследование крови подтвердило диагноз респираторного микоплазмоза.
F. Ronchetti и соавт. [35] провели в 2003 г. исследование, которое показало, что C. pneumoniae может являться этиологическим фактором в развитии хронического гнойного среднего отита. Были прооперированы 32 пациента с хроническим гнойным средним отитом и холестеатомой. 32 образца матрикса холестеатомы с помощью микротома были фрагментированы на 3 части: внутреннюю (матрикс), промежуточную (периматрикс) и наружную (грануляционная ткань). Методом ПЦР исследовался каждый фрагмент с целью обнаружения ДНК C. pneumoniae, M. pneumoniae и H. influenzae. В 16 из 32 образцов была найдена ДНК C. pneumoniae на уровне внутренней части матрикса холестеатомы, 4 образца содержали ДНК H. influenzae в грануляциях, M. pneumoniae не была найдена ни в одном из образцов. Таким образом, авторы предполагали, что респираторная хламидийная инфекция может провоцировать развитие хронического гнойного воспаления в среднем ухе.
В 1990 г. японские оториноларингологи H. Ogawa,K. Hashiguchi, Y. Kazuyama [36] описали случай респираторной инфекции, ассоциированной с C. trachomatis у 8-летней девочки с хроническим тонзиллитом в анамнезе. При осмотре ребенка, которого беспокоили продуктивный кашель, насморк и заложенность ушей, был поставлен диагноз острый синусит с дисфункцией слуховых труб и назначена терапия β-лактамными препаратами. На фоне лечения фиксировалось временное улучшение, но спустя неделю появилась боль в ушах. После повторного осмотра и импедансометрии был диагностирован левосторонний экссудативный средний отит. После проведения парацентеза аспират из барабанной полости был исследован на наличие ДНК C. trachomatis, которая была выявлена. Назначение антихламидийной терапии в течение 1 нед позволило купировать симптомы. Тем не менее рецидив инфекции, наступивший через месяц, потребовал хирургического лечения — шунтирования барабанной полости, проведения аденотонзиллэктомии, а также назначения повторного курса противохламидийной терапии.
Анализируя все вышеизложенное, необходимо отметить, что воспалительные заболевания ЛОР-органов хламидийной и микоплазменной этиологии имеют признаки малосимптомного воспаления, носят затяжной, рецидивирующий характер, при этом отсутствует лечебный эффект от традиционной терапии β-лактамными антибиотиками. Хламидийная инфекция характеризуется появлением серозного отделяемого, а микоплазменная преимущественно слизисто-гнойным характером патологического отделяемого. Для атипичной инфекции чаще всего характерно двустороннее поражение ЛОР-органов в сочетании с поражением нижних дыхательных путей. При сборе анамнеза следует обратить внимание на такие заболевания, как бронхит, бронхиальная астма, пневмония, урогенитальные инфекции, конъюнктивит, парадонтит, наличие у близких родственников хламидийной инфекции (так называемый «семейный хламидиоз»).
Методы диагностики хламидийной и микоплазменной инфекции
Многообразие и неспецифичность клинических проявлений осложняет диагностику хламидиозов и микоплазмозов.
Учитывая биологические свойства данных микроорганизмов, диагностика хламидийной и микоплазменной инфекции должна носить комплексный характер и основываться на жалобах больного, данных объективного осмотра, анамнеза, лабораторного обследования, при этом, безусловно, решающее значение имеют современные лабораторные методы диагностики [37].
В настоящее время существуют прямые и непрямые тесты обнаружения хламидийной инфекции. К прямым относятся культуральные, иммунологические и молекулярно-биологические методы. К непрямым — серологические тесты, которые успешно используются для оценки тяжести и периодов течения воспалительных заболеваний хламидийного генеза, в установлении диагноза персистирующей, бессимптомной, вялотекущей инфекции, когда другие методы лабораторной диагностики не позволяют выявить структуры возбудителя или живые микроорганизмы [38].
Метод выделения хламидий в культуре клеток (культуральный), предложенный еще в 1973 г., благодаря своей высокой специфичности, рассматривается многими авторами как эталонный метод выявления хламидий [39]. Однако использование этого метода ограничивается высокой трудоемкостью и дороговизной [40]. Исследованием M. Hammerschlag [41] было доказано, что ПЦР значительно превосходит культуральный метод по чувствительности выявления хламидийной инфекции. При этом бактериологический (цитологический) метод основан на выявлении морфологических структур хламидий в пораженных эпителиальных клетках и малоинформативен, что связано с низкой чувствительностью — от 5 до 30% [42].
ДНК-диагностика является достаточно точным методом, с помощью которого идентифицируют последовательность нуклеотидов в геноме исследуемого микроорганизма. Для выявления хламидийной инфекции можно применять следующие методы амплификации нуклеиновых кислот: полимеразную цепную реакцию (ПЦР), лигазную цепную реакцию и транскрипционную амплификацию. Чувствительность методов ДНК-диагностики, по данным разных авторов, колеблется от 50 до 95%, а специфичность — от 65 до 98% [39]. Метод ПЦР позволяет обнаружить возбудителя по нескольким копиям ДНК. Этот высокочувствительный тест, казалось бы, позволяет безоговорочно судить о наличии хламидий или микоплазм, однако есть опасность гипердиагностики из-за ложноположительных результатов и невозможности дифференцировать погибших и жизнеспособных возбудителей [3].
Метод ПЦР в реальном времени (Real-Time PCR) отличается от классической ПЦР диагностики тем, что есть возможность количественного определения ДНК/РНК инфекционных агентов в исследуемом материале, отсутствует стадия электрофореза, менее строгие требования к организации ПЦР-лаборатории и наличие автоматической регистрации и интерпретации полученных результатов. Сущность метода заключается в исследовании накопления продуктов амплификации с помощью специального прибора без последующего электрофореза. Так как кинетика накопления продуктов амплификации связана с исходным количеством матрицы, это дает возможность точно оценить ее количество. Отсутствие стадии электрофореза позволяет минимизировать риск контаминации продуктами ПЦР и таким образом резко уменьшить число ложноположительных результатов [43].
Из серологических методов диагностики для выявления хламидийной инфекции применяют реакцию связывания комплемента (РСК), реакцию непрямой гемагглютинации (РНГА), реакцию непрямой иммунофлюоресценции (РНИФ), иммуноферментный анализ (ИФА). На сегодняшний день из серологических методов в диагностике хламидийной и микоплазменной инфекции ИФА является оптимальным, чувствительность его для определения хламидийных тест-систем — от 75 до 95%, специфичность — от 70 до 95% [44]. При использовании метода РНИФ доказательной считается 4-кратная сероконверсия специфических антител в парных сыворотках крови. Парные сыворотки берутся с интервалом в 7—14 дней. Существует и более современный и чувствительный метод — тест ELISA (Enzyme-linked immunosorbent assay-ИФА), позволяющий определить специфические антитела классов IgM и IgG к хламидии и микоплазме. Обнаружение в крови больных антител класса IgM доказывает острую фазу инфекции, наличие антител класса IgG свидетельствует о недавно перенесенной инфекции или рецидиве заболевания. Таким образом, с помощью теста ELISA, путем определения концентрации специфических антител 2 классов можно не только установить наличие инфекции, но и примерные сроки ее начала. При этом нет необходимости оценки сероконверсии в парных сыворотках [45].
В настоящее время в диагностике респираторного хламидиоза применяют одновременно два теста: прямой и непрямой [46].
Для выявления микоплазм можно использовать 3 группы методов: культуральные, серологические (определение антигенов микоплазм), молекулярно-биологические (ПЦР). Антигены микоплазм можно выявлять при помощи реакции агрегатгемагглютинации (РАГА), прямой реакции иммунофлюоресценции (ПИФ), реакции непрямой гемагглютинации (РНГА) и с помощью иммуноферментного анализа (ИФА) [47].
Для диагностики микоплазменной инфекции в настоящее время широко используют методы определения бактериальных антигенов инфекционного агента, в частности ПЦР и ПЦР в real-time режиме и РНИФ-метод. Эти методы весьма эффективны при активном течении заболевания, особенно в случаях, когда очаг воспаления доступен для качественного взятия образца. Часто применяют метод определения количества антител с помощью ИФА. Определение количества специфических антител, т.е. антител, синтезированных иммунной системой человека в ответ на проникновение инфекционного агента, одинаково эффективен как при остром воспалительном процессе, так и при вяло текущих процессах. При успешном лечении примерно через 3 мес после окончания приема антибиотиков IgG должны отсутствовать [48].
Особенности антибактериальной терапии хламидийной и микоплазменной инфекции
Основными трудностями в лечении хламидийно-микоплазменной инфекции является постоянно растущая антибиотикорезистентность хламидий и микоплазм, нерациональная антибиотикотерапия, участие вирусно-бактериальных ассоциаций, грибковой микрофлоры в развитии острых и хронических заболеваний ЛОР-органов [8].
Рациональное применение антибактериальных препаратов при хламидийной и микоплазменной инфекции является важнейшей частью комплексной терапии.
При подборе антибактериальной терапии больным с хламидийной инфекцией надо учитывать особенность цикла развития хламидий. Поэтому при лечении хламидийной инфекции важно учитывать как вид возбудителя, так и спектр его чувствительности к антибактериальным препаратам, а также фазу цикла его развития. Максимально чувствительными к антибактериальным веществам являются только РТ в периоде их активной жизни. ЭТ являются значительно менее метаболически активной формой внеклеточного существования хламидий и значительно более устойчивы к воздействию антибактериальных препаратов [5].
Современные макролиды являются препаратами выбора для лечения хламидийной и микоплазменной инфекции, разделяются по химической структуре на 14-членные, к которым относятся рокситромицин, кларитромицин; 15-членные (азалиды) — азитромицин и 16-членные: джозамицин, спирамицин, мидекамицин.
Проникая внутрь фагоцитов, макролиды усиливают способность клеток к хемотаксису, инициируют образование активных форм кислорода, что в конечном итоге активирует О2-зависимую антимикробную систему фагоцитов [5].
Фторхинолоны, так же как и макролиды, относятся к антибиотикам выбора для лечения хламидиоза и микоплазмоза. Антимикробное действие фторхинолонов связано с воздействием их на ДНК-гиразу и топоизомеразу IV. ДНК-гираза вызывает негативную суперспирализацию превращения ДНК в ковалентно закрытую циркуляторную структуру и ведет к обратимому связыванию витков ДНК. Связывание фторхинолонов с ДНК-гиразой ингибирует реакции вторичного связывания после разрыва связей [5]. ДНК-гираза и топоизомераза IV необходимы для репликации бактериальных ДНК. Топоизомераза IV запускает декатинацию ДНК-механизма, с помощью которого две дочерние хромосомы разделяются после удвоения бактериальной хромосомы, приводя к утрате жизнедеятельности клеткой [49].
В настоящее время, благодаря оптимальным фармакокинетическим и фармакодинамическим свойствам, целесообразно назначение фторхинолонов IV поколения: моксифлоксацин, гемифлоксацин.
Антибиотики тетрациклинового ряда можно отнести к группе резервных препаратов для лечения хламидийной и микоплазменной инфекции. Доксициклин сохраняет хламидоцидную концентрацию в крови в течение 72 ч после завершения его приема, он также является активным в отношении микоплазм [50].
При лечении хламидиоза выбор антибиотиков осуществляют в пользу макролидов, так как они по сравнению с тетрациклинами и фторхинолонами вызывают меньше побочных эффектов, а также в меньшей степени способствуют формированию персистирующей формы хламидийной инфекции. В тех случаях, когда у больного имеются незначительные проявления диспепсии, а у выделенных хламидий отмечается резистентность к макролидам, целесообразно применять фторхинолоны и тетрациклины. При отсутствии сопутствующих болезней и хорошей переносимости препаратов наиболее эффективными являются схемы непрерывной антибиотикотерапии. Лечение больных в таких случаях проводится в течение 18—21 сут после подготовительного этапа на фоне продолжающейся антибиотикотерапии, энзимотерапии, иммунотерапии и физиотерапии. При генерализованных формах болезни показано дополнительное применение методов эфферентной терапии, оксигенотерапии, УФО и лазерного облучения крови. При наличии у больного сопутствующих болезней, повышенной чувствительности к химиопрепаратам, выраженной полиантибиотикорезистентности у хламидий целесообразно этиотропную терапию проводить методом «пульс-терапии» тремя или четырьмя циклами продолжительностью по 6—7 дней, с восстановительным интервалом в 5—6 сут [5]. При «пульс-терапии» используется комплекс из нескольких антибиотиков разных групп, назначаемых короткими курсами в комплексе с иммунотерапией, физиотерапией и местным лечением. Преимущества «пульс-терапии» заключаются в возможности длительного (в течение 1 мес) поддержания терапевтической концентрации препарата.
Анализируя данные литературы, можно сказать, что проблема хламидийной и микоплазменной инфекции является актуальной и современной. Сведения и четкие представления об особенностях клинического течения до настоящего времени носят разрозненный характер и представлены не в полном объеме. Не определены и наиболее неблагоприятные сочетания микоплазменной и хламидийной инфекции с другими патогенами, которые впоследствии могут оказывать влияние на рецидивирующее течение воспалительных заболеваний ЛОР-органов. В литературе представлено больше сведений о хламидийном поражении ЛОР-органов в сравнении с микоплазменной инфекцией, однако необходимо отметить, что роль микоплазменной инфекции в поражении верхних дыхательных путей и уха не менее значима.
Сумамед® (Sumamed®), Антибиотик — азалид , описание, отзывы, цены на препарат, заказ в аптеках, состав, способ применения, показания, противопоказания, побочные действия, взаимодействие, Плива Хрватска д.о.о. (Хорватия).
Побочные действия
В клинических испытаниях большинство побочных эффектов, о которых сообщалось, были от легкой до умеренной степени выраженности и обратимыми после отмены азитромицина. О потенциально серьезных побочных эффектах, таких как ангионевротический отек и холестатическая желтуха, сообщалось редко. Примерно 0,7% пациентов (взрослых и детей), участвовавших в 5-дневных клинических испытаниях многократных доз, прекратили терапию азитромицином из-за развития побочных эффектов, связанных с лечением. У взрослых, получавших азитромицин в дозе 500 мг/сут, через 3 дня лечения частота прекращения приема из-за побочных эффектов, связанных с лечением, составила 0,6%. В клинических испытаниях с участием педиатрических пациентов при назначении 30 мг/кг либо в виде разовой дозы азитромицина, либо в течение 3 дней прекращение приема азитромицина, связанное с развитием побочных эффектов, ассоциированных с лечением, составило около 1%. Большинство побочных эффектов, приведших к отмене, были связаны с ЖКТ, в т.ч. тошнота, рвота, диарея или боль в животе.
Результаты клинических испытаний
Поскольку клинические испытания проводятся с различным набором условий, частота побочных реакций, наблюдаемая в этих клинических испытаниях, может не совпадать с полученной в других клинических исследованиях и наблюдаемой в клинической практике.
Многодозовые схемы. В целом наиболее частыми побочными реакциями, ассоциированными с лечением, у взрослых пациентов, получавших многократные дозы азитромицина, были эффекты со стороны желудочно-кишечной системы. Наиболее часто сообщалось о таких неблагоприятных реакциях, как диарея /жидкий стул (4–5%), тошнота (3%) и боль в животе (2–3%).
Каких-либо других побочных эффектов, связанных с лечением, с частотой более 1% у пациентов, получавших несколько доз азитромицина, не наблюдалось.
Нежелательные реакции, которые возникали с частотой ≤1%, включали следующие.
Со стороны ССС: сердцебиение, боль в груди.
Со стороны ЖКТ: диспепсия, метеоризм, рвота, мелена, холестатическая желтуха.
Со стороны мочеполовой системы: кандидоз, вагинит, нефрит.
Со стороны нервной системы: головокружение, головная боль, вертиго, сонливость.
Аллергические реакции: сыпь, кожный зуд, фоточувствительность, ангионевротический отек.
Режим однократной дозы 1 г. В целом наиболее частые побочные эффекты у пациентов, получавших азитромицин однократно в дозе 1 г, имели отношение к желудочно-кишечной системе и были зарегистрированы чаще, чем у пациентов, получавших режим многократных доз.
Побочные эффекты, отмеченные у пациентов при однократном приеме азитромицина с частотой 1% и более включали такие, как диарея /жидкий стул (7%), тошнота (5%), боль в животе (5%), рвота (2%), диспепсия (1%), вагинит (1%).
Режим однократной дозы 2 г. В целом наиболее частые побочные эффекты у пациентов, получавших азитромицин однократно в дозе 2 г, имели отношение к желудочно-кишечной системе.
Побочные эффекты, отмеченные у пациентов при однократном приеме азитромицина в этом исследовании с частотой 1% и более включали такие, как тошнота (18%), диарея /жидкий стул (14%), рвота (7%), боль в животе (7%), вагинит (2%), диспепсия (1%), головокружение (1%). Большинство жалоб носили умеренный характер.
Педиатрические пациенты
Режимы однократного и многократного приема. Типы побочных эффектов у педиатрических пациентов были сравнимы с таковыми у взрослых, с разной частотой встречаемости для режимов дозирования, рекомендованных в педиатрической практике.
Острый средний отит: при рекомендуемой общей дозировке 30 мг/кг наиболее частыми побочными эффектами (≥1%), связанными с лечением, были диарея, боль в животе, рвота, тошнота, сыпь.
Частота побочных эффектов, в зависимости от режима дозирования, при 1-, 3- и 5-дневном режиме дозирования составила: диарея — 4,3; 2,6 и 1,8%; боль в животе — 1,4; 1,7 и 1,2%; рвота — 4,9; 2,3 и 1,1%; тошнота — 1, 0,4 и 0,5%; сыпь — 1, 0,6 и 0,4%.
Внебольничная пневмония: для рекомендуемого режима дозировки 10 мг/кг в 1-й день с последующим приемом 5 мг/кг во 2–5-й дни, наиболее частыми побочными эффектами, связанными с лечением, были диарея/жидкий стул (5,8%), боль в животе (1,9%), рвота (1,9%), тошнота (1,9%), и сыпь (1,6%).
Фарингит/тонзиллит: при рекомендуемом режиме дозирования 12 мг/кг в 1–5-й дни, наиболее частыми побочными эффектами, связанными с лечением, были диарея (5,4%), боль в животе (3,4%), рвота (5,6%), тошнота (1,8%), сыпь (0,7%), головная боль (1,1%).
Каких-либо других побочных эффектов, связанных с лечением и встречавшихся с частотой >1%, в педиатрической практике не наблюдалось ни при каких схемах лечения.
Побочные эффекты, наблюдавшиеся с частотой ≤1%, включали следующие.
Со стороны ССС: боль в груди.
Со стороны ЖКТ: диспепсия, запор, анорексия, энтерит, метеоризм, гастрит, желтуха, жидкий стул, кандидоз полости рта.
Со стороны крови и лимфатической системы: анемия, лейкопения.
Со стороны нервной системы: головная боль (при среднем отите), гиперкинезия, головокружение, ажитация, нервозность, инсомния.
Общие: лихорадка, отек лица, утомляемость, грибковая инфекция, недомогание, боль.
Аллергические: сыпь и аллергическая реакция.
Со стороны респираторной системы: усиление кашля, фарингит, плевральный выпот, ринит.
Со стороны кожи и ее придатков: экзема, грибковый дерматит, зуд, потливость, крапивница, везикулобуллезная сыпь.
Со стороны органов чувств: конъюнктивит.
Постмаркетинговый опыт
Нежелательные реакции, о которых сообщалось при приеме азитромицина в постмаркетинговый период у взрослых и/или педиатрических пациентов, для которых причинно-следственная связь не установлена, включают следующие.
Аллергические реакции: артралгия, отек, крапивница и ангионевротический отек.
Со стороны ССС: аритмия, включая желудочковую тахикардию и гипотензию. Были сообщения о случаях удлинения интервала QT и torsade de pointes.
Со стороны органов ЖКТ: анорексия, запор, диспепсия, метеоризм, рвота/диарея, редко приводившие к дегидратации, псевдомембранозный колит, панкреатит, кандидоз полости рта, стеноз привратника, имеются редкие сообщения об изменении цвета языка.
Общие: астения, парестезия, утомляемость, недомогание и анафилаксия (редко с летальным исходом).
Со стороны мочеполовой системы: интерстициальный нефрит, острая почечная недостаточность и вагинит.
Со стороны кроветворения: тромбоцитопения.
Со стороны печени/желчевыводящих путей: побочные реакции, связанные с дисфункцией печени.
Со стороны нервной системы: судороги, головокружение/вертиго, головная боль, сонливость, гиперактивность, нервозность, возбуждение и обморок.
Нарушения психики: агрессивная реакция и тревога.
Со стороны кожи и ее придатков: зуд, серьезные кожные реакции, включая многоформную эритему, синдром Стивенса-Джонсона, токсический эпидермальный некролиз и DRESS-синдром.
Со стороны органов чувств: нарушения слуха, включая потерю слуха, глухоту и/или шум в ушах, а также сообщения об извращении и/или потере вкуса/обоняния.
Лабораторные отклонения
Сообщалось о клинически значимых отклонениях (безотносительно к связи с лекарством), зарегистрированных во время клинических испытаний с частотой более 1%: снижение Hb, гематокрита, лимфоцитов, нейтрофилов и глюкозы в крови, повышение в сыворотке крови КФК, калия, АЛТ, ГГТ, АСТ, билирубина, креатинина, глюкозы в крови, количества тромбоцитов, лимфоцитов, нейтрофилов и эозинофилов; с частотой менее 1%: лейкопения, нейтропения, снижение натрия, калия, количества тромбоцитов, повышение количества моноцитов, базофилов, бикарбоната, ЩФ сыворотки, билирубина, ЛДГ и фосфатов. У большинства пациентов с повышенным уровнем креатинина сыворотки также были аномальные значения исходного уровня.
Изменения лабораторных тестов были обратимыми.
В клинических испытаниях многократных доз с участием более 5000 пациентов 4 пациента прекратили терапию азитромицином из-за связанных с лечением нарушений показателей ферментов печени и 1 — из-за нарушения функции почек.
Педиатрические пациенты
Одно-, трех- и пятидневные режимы. Лабораторные данные, собранные в ходе сравнительных клинических испытаний с использованием двух 3-дневных схем (30 или 60 мг/кг в разделенных дозах в течение 3 дней) или двух 5-дневных схем (30 или 60 мг/кг) в разделенных дозах в течение 5 дней) были сходными при всех схемах приема азитромицина, при этом наиболее клинически значимые лабораторные отклонения встречались с частотой 1–5%. Лабораторные данные для пациентов, получавших 30 мг/кг в виде однократной дозы, были собраны в одноцентровом исследовании. В этом испытании наблюдалось абсолютное количество нейтрофилов между 500–1500 клеток/мм 3 у 10 из 64 пациентов, получавших 30 мг/кг однократно, у 9 из 62 пациентов, получавших 30 мг/кг в течение 3 дней, и у 8 из 63 пациентов из группы сравнения. Ни у одного пациента не было абсолютного числа нейтрофилов <500 клеток/мм 3 .
В клинических испытаниях многократных доз с участием примерно 4700 педиатрических пациентов ни у одного пациента терапия не была прекращена из-за лабораторных отклонений, связанных с лечением.
Что такое хламидиоз и как его лечить? Диагностика и признаки заболевания. Как проявляется хламидиоз у мужчин и женщин? Рекомендации от специалистов АО «Медицина» (клиника академика Ройтберга).
Часто возникающие вопросы
Передается ли хламидиоз через поцелуи?
Нет, передача возбудителя происходит только во время полового акта, причем его характер может быть не только вагинальным, но и оральным или анальным. Контактно-бытовой путь инфицирования через предметы гигиены тоже возможен, но такие случаи чрезвычайно редки.
Можно ли заразиться повторно?
Перенесенное заболевание не формирует иммунитета к инфекции, поэтому после полного излечения человек может повторно заражаться.
Как можно понизить риск заражения хламидиозом?
Меры профилактики включают:
- воздержание от беспорядочных и случайных половых связей;
- обязательное использование презервативов при случайных половых контактах;
- обследование на половые инфекции после случайного полового акта, особенно если он был незащищенным;
- при обнаружении инфекции – полный отказ от половых контактов во время курса лечения, оповещение всех сексуальных партнеров об инфицировании.
При планировании беременности желательно пройти всестороннее обследование, в том числе на выявление хламидиоза.


