Оглавление
- 1 Современные аспекты лечения воспалительных заболеваний органов малого таза у женщин
- 2 ФЛЕГМОНЫ И АБСЦЕССЫ — современные возможности лечения
- 3 ЦЕФАЗОЛИН-АКОС 1,0 N1 ФЛ
- 4 Что еще важно знать про прививку «КовиВак»?
Воспалительные заболевания органов малого таза характеризуются различными проявлениями, в зависимости от уровня поражения и силы воспалительной реакции. Заболевание развивается при проникновении в половые пути возбудителя (энтерококки, бактероиды, хлами
Современные аспекты лечения воспалительных заболеваний органов малого таза у женщин
Воспалительные заболевания органов малого таза характеризуются различными проявлениями, в зависимости от уровня поражения и силы воспалительной реакции. Заболевание развивается при проникновении в половые пути возбудителя (энтерококки, бактероиды, хлами
Воспалительные заболевания органов малого таза характеризуются различными проявлениями, в зависимости от уровня поражения и силы воспалительной реакции. Заболевание развивается при проникновении в половые пути возбудителя (энтерококки, бактероиды, хламидии, микоплазмы, уреаплазмы, трихомонады) и при наличии благоприятных условий для его развития и размножения. Эти условия имеют место в послеродовом или послеабортном периодах, во время менструаций, при различных внутриматочных манипуляциях (введении внутриматочных контрацептивов (ВМК), гистероскопии, гистеросальпингографии, диагностических выскабливаниях) [1, 5].

Существующие естественные защитные механизмы, такие как анатомические особенности, местный иммунитет, кислая среда влагалища, отсутствие эндокринных нарушений или серьезных экстрагенитальных заболеваний, способны в подавляющем большинстве случаев предотвратить развитие генитальной инфекции.
В ответ на инвазию того или иного микроорганизма возникает воспалительный ответ, который, исходя из последних концепций развития септического процесса, принято называть «системным воспалительным ответом» [16, 17, 18].
Эндометрит
Острый эндометрит всегда требует антибактериальной терапии. Воспалительным процессом поражается базальный слой эндометрия вследствие инвазии специфических или неспецифических возбудителей. Защитные механизмы эндометрия, врожденные или приобретенные, такие как Т-лимфоциты и другие элементы клеточного иммунитета, напрямую связаны с действием половых гормонов, особенно эстрадиола, действуют совместно с популяцией макрофагов и защищают организм от повреждающих факторов. С началом менструации этот барьер на большой поверхности слизистой оболочки исчезает, что делает возможным ее инфицирование. Другой источник защиты в матке — это инфильтрация подлежащих тканей полиморфно-ядерными лейкоцитами и богатое кровоснабжение матки, способствующее адекватной перфузии органа кровью и содержащимися в ее сыворотке неспецифическими гуморальными элементами защиты: трансферрином, лизоцимом, опсонинами [16].
Воспалительный процесс может распространиться и на мышечный слой, и возникает метроэндометрит и метротромбофлебит с тяжелым клиническим течением. Воспалительная реакция характеризуется расстройством микроциркуляции в пораженных тканях, выраженной экссудацией, при присоединении анаэробной флоры может возникнуть некротическая деструкция миометрия [12].
Клинические проявления острого эндометрита характеризуются уже на 3–4-й день после занесения инфекции повышением температуры тела, тахикардией, лейкоцитозом с палочкоядерным сдвигом, увеличением скорости оседания эритроцитов (СОЭ). Умеренное увеличение матки сопровождается болезненностью, особенно по ее ребрам (по ходу кровеносных и лимфатических сосудов). Появляются гнойно-кровянистые выделения. Острая стадия эндометрита продолжается 8–10 дней и требует достаточно серьезного лечения. При правильном лечении процесс заканчивается, реже переходит в подострую и хроническую форму, еще реже, при самостоятельной и беспорядочной терапии антибиотиками, эндометрит может принимать более легкое абортивное течение [5, 12].
Лечение острого эндометрита вне зависимости от тяжести его проявлений начинается с антибактериальной инфузионной, десенсибилизирующей и общеукрепляющей терапии.
Антибиотики лучше всего назначать с учетом чувствительности к ним возбудителя, дозы и длительность применения антибиотиков определяются тяжестью заболевания. Из-за угрозы анаэробного инфицирования рекомендуется дополнительное применение метронидазола. Учитывая очень бурное течение эндометрита, из антибиотиков предпочтительны цефалоспорины с аминогликозидами и метронидазолом. Например, цефамандол (или цефуроксим, цефотаксим) по 1,0–2,0 г 3–4 раза в день внутримышечно или внутривенно капельно + гентамицин по 80 мг 3 раза в сутки внутримышечно + метронидазол по 100 мл внутривенно капельно.
Вместо цефалоспоринов можно использовать полусинтетические пенициллины (при абортивном течении), например ампициллин по 1,0 г 6 раз в сутки. Длительность такой комбинированной антибактериальной терапии зависит от клиники и лабораторного ответа, но не менее 7–10 дней.
В качестве профилактики дисбактериоза с первых дней лечения антибиотиками используют нистатин по 250 000 ЕД 4 раза в день или флуконазол по 50 мг в день в течение 1–2 нед внутрь или внутривенно [5].
Дезинтоксикационная инфузионная терапия может включать назначение инфузионных средств, например: раствор Рингера — 500 мл, полиионные растворы — 400 мл, 5% раствор глюкозы — 500 мл, 10% раствор хлорида кальция — 10 мл, унитиол с 5% раствором аскорбиновой кислоты по 5 мл 3 раза в сутки. При наличии гипопротеинемии целесообразно проводить инфузии белковых растворов (альбумин), кровозамещающих растворов, плазмы, эритроцитарной массы, препаратов аминокислот [12].
Физиотерапевтическое лечение занимает одно из ведущих мест в лечении острого эндометрита. Оно не только уменьшает воспалительный процесс в эндометрии, но и стимулирует функцию яичников. При нормализации температурной реакции целесообразно назначать ультразвук малой интенсивности, индуктотермию электромагнитным полем высокой частоты или ультравысокой частоты (УВЧ), магнитотерапию, лазеротерапию.
-
Нестероидные противовоспалительные средства (оказывают противовоспалительное, анальгезирующее действие):
– парацетамол + ибупрофен по 1–2 таблетки 3 раза в день — 10 дней;
– диклофенак ректально в свечах или перорально по 50 мг 2 раза в день — 10–15 дней;
– индометацин ректально в свечах или перорально по 50 мг 2 раза в день — 10–15 дней;
– напроксен по 500 мг 2 раза в день ректально в свечах или перорально — 10–15 дней.
– метилглукамина акридонацетат по 250 мг внутримышечно через день — 10 дней;
– оксодигидроакридинилацетат натрия по 250 мг внутримышечно через день — 10 дней.
Рекомендуется дополнительное лечение.
- Комбинированный энзимный препарат (оказывает противовоспалительное, трофическое действие): вобэнзим по 3–5 таблеток 3 раза в день.
- Гомеопатические средства (оказывают противовоспалительное действие, в сочетании с другими препаратами нормализует функцию яичников): гинекохель по 10 капель 3 раза в день.
- Традиционные методы терапии: физиотерапия, фитотерапия, гирудотерапия, иглорефлексотерапия, лечебная физкультура.
- Методы гравитационной хирургии крови: плазмаферез, эндоваскулярное лазерное облучение крови (ЭЛОК), ультрафиолетовое облучение крови, внутривенно введение озонированного 0,9% раствора натрия хлорида.
- Комбинированные пероральные контрацептивные препараты (средне-, низкодозированные, монофазные) по 1 таблетке в день — с 5-го по 25-й день цикла в течение 3–6 мес:
– этинилэстрадиол 30 мкг + левоноргестрел 150 мкг (ригевидон);
– этинилэстрадиол 35 мкг + норгестимат 250 мкг (силест);
– этинилэстрадиол 30 мкг + гестоден 75 мкг (фемоден);
– этинилэстрадиол 30 мкг + дезогестрел 150 мкг (марвелон).
Дополнительное лечение в дни менструаций включает следующее.
Тетрациклины (обладают широким спектром действия: грамположительные кокки, спорообразующие бактерии, неспорообразующие бактерии, грамотрицательные кокки и палочки, хламидии, микоплазмы): доксициклин по 100 мг 2 раза в день.
Макролиды (активны в отношении грамположительных кокков, грамотрицательных бактерий, гарднерелл, хламидий, микоплазм, уреаплазм):
– азитромицин по 500 мг 2 раза в день;
– рокситромицин по 150 мг 2 раза в день;
– кларитромицин по 250 мг 2 раза в день.
Фторхинолоны (активны в отношении всех грамположительных и грамотрицательных бактерий): ципрофлоксацин по 500 мг 2 раза в день; офлоксацин — 800 мг однократно в день в течение 10–14 дней.
Производные нитроимидазола (активны в отношении анаэробов, простейших): метронидазол по 500 мг 4 раза в день.
Противогрибковые средства (активны в отношении грибов рода Candida):
– нистатин по 250 000 ЕД 4 раза в день;
– натамицин по 100 мг 4 раза в день;
– флуконазол — 150 мг однократно.
Острый сальпингоофорит
Относится к самым частым заболеваниям воспалительной этиологии у женщин. Каждой пятой женщине, перенесшей сальпингоофорит грозит бесплодие. Аднексит может быть причиной высокого риска внематочной беременности и патологического течения беременности и родов. Первыми поражаются маточные трубы, при этом воспалительным процессом могут быть охвачены все слои слизистой оболочки одной или обеих труб, но чаще возникает катаральное воспаление слизистой оболочки трубы — эндосальпингит. Воспалительный экссудат, скапливаясь в трубе, нередко вытекает через ампулярное отверстие в брюшную полость, вокруг трубы образуются спайки, и брюшное отверстие трубы закрывается. Развивается мешотчатая опухоль в виде гидросальпинкса с прозрачным серозным содержимым или в виде пиосальпинкса с гнойным содержимым. В дальнейшем серозный экссудат гидросальпинкса рассасывается в результате лечения, а гнойный пиосальпинкс может перфорировать в брюшную полость. Гнойный процесс может захватывать более широкие области малого таза, распространяясь на все близлежащие органы [9, 10, 13].
Воспаление яичников (оофорит) как первичное заболевание встречается редко, инфицирование происходит в области лопнувшего фолликула, так как остальная ткань яичника хорошо защищена покрывающим зародышевым эпителием. В острой стадии наблюдается отек и мелкоклеточная инфильтрация. Иногда в полости фолликула желтого тела или мелких фолликулярных кист образуются гнойники, микроабсцессы, которые, сливаясь, формируют абсцесс яичника или пиоварий. Практически диагностировать изолированный воспалительный процесс в яичнике невозможно, да в этом и нет необходимости. В настоящее время лишь у 25–30% больных с острым аднекситом отмечается выраженная картина воспаления, у остальных пациентов наблюдается переход в хроническую форму, когда терапия прекращается после быстрого стихания воспаления.
Острый сальпингоофорит лечится также антибиотиками, (предпочтительнее фторхинолоны III поколения — ципрофлоксацин, офлоксацин, пефлоксацин), так как нередко сопровождается пельвиоперитонитом — воспалением тазовой брюшины.
При нетяжелой форме назначается следующее.
1. Антибактериальная терапия перорально в течение 5–7 дней.
- Комбинация пенициллинов и ингибиторов b-лактамазы (обладают широким спектром действия (стафилококки, кишечная палочка, протей, клебсиелла, шигелла, гонококк, бактероиды, сальмонелла): амоксициллин + клавулановая кислота по 625 мг 3 раза в день.
- Тетрациклины (обладают широким спектром действия: грамположительные кокки, спорообразующие бактерии, неспорообразующие бактерии, грамотрицательные кокки и палочки, хламидии, микоплазмы): доксициклин по 100 мг 2 раза в день.
- Макролиды (активны в отношении грамположительных кокков, грамотрицательных бактерий, гарднерелл, хламидий, микоплазм, уреаплазм):
– азитромицин по 500 мг 2 раза в день;
– рокситромицин по 150 мг 2 раза в день;
– кларитромицин по 250 мг 2 раза в день.
– ципрофлоксацин по 500 мг 2 раза в день;
– офлоксацин — 800 мг однократно в день — 10–14 дней.
2. Производные нитроимидазола перорально (активны в отношении анаэробов, простейших):
– метронидазол по 500 мг 3 раза в день;
– орнидазол по 500 мг 3 раза в день.
3. Противогрибковые средства перорально (активны в отношении грибов рода Candida):
– нистатин по 500 000 ЕД 4 раза в день;
– натамицин по 100 мг 4 раза в день;
– флуконазол — 150 мг однократно.
4. Антигистаминные препараты перорально (предупреждают развитие аллергических реакций):
– фексофенадин по 180 мг 1 раз в день;
– хлоропирамин по 25 мг 2 раза в день.
Дополнительное лечение включает следующее.
-
Нестероидные противовоспалительные средства (оказывают противовоспалительное, анальгезирующее действие):
– парацетамол + ибупрофен по 1–2 таблетки 3 раза в день;
– диклофенак или индометацин ректально в свечах или перорально по 50 мг 2 раза в день — 10–15 дней;
– напроксен по 500 мг 2 раза в день ректально в свечах или перорально — 10–15 дней.
При тяжелом течении назначаются препараты следующих групп.
1. Антибактериальная терапия перорально в течение 7–10 дней. Во время антибактериальной терапии оценка клинической эффективности комбинации препаратов проводится через 3 дня, при необходимости — смена препаратов через 5–7 дней.
- Цефалоспорины III, IV поколений (активны в отношении грамотрицательных бактерий, стафилококков): цефотаксим, цефтриаксон, цефепим по 0,5–1 г 2 раза в день внутривенно.
- Комбинация пенициллинов и ингибиторов β-лактамазы (обладает широким спектром действия: стафилококки, кишечная палочка, протей, клебсиелла, шигелла, гонококк, бактероиды, сальмонелла): амоксициллин + клавулановая кислота по 1,2 г 3 раза в день внутривенно.
- Фторхинолоны (активны в отношении всех грамположительных и грамотрицательных бактерий):
– ципрофлоксацин 1000 мг однократно в день;
– пефлоксацин, офлоксацин по 200 мг 2 раза в день внутривенно.
– гентамицин по 240 мг 1 раз в день внутривенно;
– амикацин по 500 мг 2 раза в день внутривенно.
2. Противогрибковые средства (активны в отношении грибов рода Candida): флуконазол 150 мг однократно перорально.
3. Производные нитроимидазола (активны в отношении анаэробов, простейших): метронидазол по 500 мг 2 раза в день внутривенно.
4. Коллоидные, кристаллоидные растворы (внутривенно капельно):
5. Витамины и витаминоподобные вещества (оказывают антиоксидантное действие). Внутривенно струйно или капельно в 0,9% растворе натрия хлорида:
– аскорбиновая кислота 5% раствор 5 мл;
Дополнительное лечение включает следующее.
- Иммуноглобулины человека — иммуноглобулин человеческий нормальный (содержит иммуноглобулин G, дополняет антибактериальную терапию при тяжелых инфекциях), внутривенно в дозе 0,2–0,8 г/кг массы тела.
- Препараты рекомбинантных интерферонов (оказывают противовирусное, иммуномодулирующее действие, усиливают действие антибиотиков): интерферон α-2β по 500 000 ME 2 раза в день ректально в свечах — 10 дней.
- Индукторы интерферонов (оказывают противовирусное, иммуномодулирующее действие):
– метилглукамина акридонацетат по 250 мг внутримышечно через день — 10 дней;
– оксодигидроакридинилацетат натрия по 250 мг внутримышечно через день — 10 дней.
Лечение при хроническом сальпингоофорите включает следующее.
-
Нестероидные противовоспалительные средства (оказывают противовоспалительное, анальгезирующее действие):
– парацетамол + ибупрофен по 1–2 таблетки 3 раза в день после еды — 10 дней;
— диклофенак или индометацин ректально в свечах или перорально по 50 мг 2 раза в день — 10–15 дней;
– напроксен по 500 мг 2 раза в день ректально в свечах или перорально — 10–15 дней.
Рекомендуется дополнительное лечение.
- Комбинированный энзимный препарат (оказывает противовоспалительное, трофическое действие): вобэнзим по 3–5 таблеток 3 раза в день.
- Традиционные методы терапии: физиотерапия, фитотерапия, гирудотерапия, иглорефлексотерапия, лечебная физкультура.
- Методы гравитационной хирургии крови: плазмаферез, ЭЛОК, ультрафиолетовое облучение крови, внутривенное введение озонированного 0,9% раствора натрия хлорида.
- Комбинированные пероральные контрацептивные препараты (средне-, низкодозированные, монофазные) по 1 таблетке в день — с 5-го по 25-й день цикла в течение 3–6 мес:
– этинилэстрадиол 30 мкг + левоноргестрел 150 мкг (ригевидон)
– этинилэстрадиол 35 мкг + норгестимат 250 мкг (силест).
– этинилэстрадиол 30 мкг + гестоден 75 мкг (фемоден)
– этинилэстрадиол 30 мкг + дезогестрел 150 мкг (марвелон).
Низкодозированные пероральные контрацептивные препараты нормализуют функцию гипоталамо-гипофизарно-яичниковой системы. При длительном приеме необходим контроль гемостаза, функций печени.
- Гомеопатические средства (оказывают противовоспалительное действие, в сочетании с другими препаратами нормализуют функцию яичников): гинекохель по 10 капель 3 раза в день.
Пельвиоперитонит
Воспаление тазовой брюшины возникает чаще всего вторично от проникновения инфекции в брюшную полость из инфицированной матки (при эндометрите, инфицированном аборте, восходящей гонорее), из маточных труб, яичников, из кишечника, при аппендиците, особенно при тазовом его расположении. При этом наблюдается воспалительная реакция брюшины с образованием серозного, серозно-гнойного или гнойного выпота. Состояние больных при пельвиоперитоните средней тяжести температура повышается, пульс учащается, однако функция сердечно-сосудистой системы нарушается незначительно. При пельвиоперитоните кишечник остается невздутым, пальпация верхней половины органов брюшной полости безболезненна, а симптомы раздражения брюшины определяются лишь над лоном и в подвздошных областях. Тем не менее больные отмечают сильные боли в нижних отделах живота, может быть задержка стула и газов, иногда рвота. Уровень лейкоцитов повышен, сдвиг лейкоцитарной формулы влево, СОЭ ускорена. Постепенно нарастающая интоксикация ухудшает состояние больных [14, 15].
Лечение сальпингоофорита с пельвиоперитонитом или без него начинается с обязательного обследования больной на флору и чувствительность к антибиотикам. Самое главное — следует определить этиологию воспаления. На сегодняшний день для лечения специфического гонорейного процесса широко используется бензилпенициллин, хотя такие препараты, как цефтриаксон, перазон, цефтазидим, предпочтительнее.
«Золотым стандартом» при лечении сальпингоофорита из антибактериальной терапии является назначение цефотаксима в дозе 1,0–2,0 г 2–4 раза в сутки внутримышечно или 1 дозу — 2,0 г внутривенно в сочетании с гентамицином по 80 мг 3 раза в сутки (можно гентамицин вводить однократно в дозе 160 мг внутримышечно). Обязательно следует сочетать эти препараты с введением метронидазола внутривенно по 100 мл 1–3 раза в сутки. Курс лечения антибиотиками следует проводить не менее 5–7 дней и варьировать можно в основном базисный препарат, назначая цефалоспорины II и III поколения (цефамандол, цефуроксим, цефтриаксон, перазон, цефтазидим и другие в дозе 2–4 г в сутки) [14].
При неэффективности стандартной антибиотикотерапии применяется ципрофлоксацин в дозировке 500 мг 2 раза в день в течение 7–10 дней.
При остром воспалении придатков матки, осложненном пельвиоперитонитом, оральное введение антибиотиков возможно лишь после проведения основного курса, и притом если в этом возникает необходимость. Как правило, такой необходимости нет, а сохранение прежних клинических симптомов может свидетельствовать о прогрессировании воспаления и о возможном нагноительном процессе.
Дезинтоксикационная терапия в основном проводится кристаллоидными и дезинтоксикационными растворами в количестве 2–2,5 л с включением растворов реополиглюкина, Рингера, полиионных растворов — ацессоля и др. Антиоксидантная терапия проводится раствором унитиола 5,0 мл с 5% раствором аскорбиновой кислоты 3 раза в сутки внутривенно [14].
С целью нормализации реологических и коагуляционных свойств крови и улучшения микроциркуляции используют ацетилсалициловую кислоту по 0,25 г/сут в течение 7–10 дней, а также внутривенно введение реополиглюкина по 200 мл (2–3 раза на курс). В дальнейшем применяют целый комплекс рассасывающей терапии и физиотерапевтического лечения (глюконат кальция, аутогемотерапию, тиосульфат натрия, гумизоль, плазмол, алоэ, фиБС) [3, 15]. Из физиотерапевтических процедур при остром процессе уместны ультразвук, который обеспечивает анальгезирующий, десенсибилизирующий, фибролитический эффекты, усиление обменных процессов и трофики тканей, индуктотермия, УВЧ-терапия, магнитотерапия, лазеротерапия, в дальнейшем — санаторно-курортное лечение.
Гнойные тубоовариальные образования
Среди 20–25% стационарных больных с воспалительными заболеваниями придатков матки у 5–9% возникают гнойные осложнения, требующие хирургических вмешательств [9, 13].
Можно выделить следующие особенности, касающиеся формирования гнойных тубоовариальных абсцессов:
- хронический сальпингит у больных с тубоовариальными абсцессами наблюдается в 100% случаев и предшествует им;
- распространение инфекции идет преимущественно интраканаликулярным путем от эндометрита (при ВМК, абортах, внутриматочных вмешательствах) к гнойному сальпингиту и оофориту;
- отмечается частое сочетание кистозных преобразований в яичниках с хроническим сальпингитом;
- наблюдается обязательное сочетание абсцессов яичника с обострением гнойного сальпингита;
- абсцессы яичника (пиовариум) формируются преимущественно из кистозных образований, нередко микроабсцессы сливаются между собой.
Встречаются следующие морфологические формы гнойных тубоовариальных образований:
- пиосальпинкс — преимущественное поражение маточной трубы;
- пиоварий — преимущественное поражение яичника;
- тубоовариальная опухоль.
Все остальные сочетания являются осложнениями этих процессов и могут протекать:
- без перфорации;
- с перфорацией гнойников;
- с пельвиоперитонитом;
- с перитонитом (ограниченным, диффузным, серозным, гнойным);
- с тазовым абсцессом ;
- с параметритом (задним, передним, боковым);
- со вторичными поражениями смежных органов (сигмоидит, вторичный аппендицит, оментит, межкишечные абсцессы с формированием свищей).
Клинически дифференцировать каждую из подобных локализаций практически невозможно и нецелесообразно, так как лечение принципиально одинаково — антибактериальная терапия занимает ведущее место как по использованию наиболее активных антибиотиков, так и по длительности их применения. При гнойных процессах последствия воспалительной реакции в тканях носят зачастую необратимый характер. Необратимость обусловлена морфологическими изменениями, их глубиной и тяжестью. Часто наблюдается тяжелое нарушение функции почек [3, 9].
Консервативное лечение необратимых изменений придатков матки малоперспективно, так как если таковое проводится, то оно создает предпосылки к возникновению новых рецидивов и усугублению нарушенных обменных процессов у больных, увеличивает риск предстоящей операции в плане повреждения смежных органов и невозможности выполнить нужный объем операции [9].
Гнойные тубоовариальные образования представляют собой тяжелый в диагностическом и клиническом плане процесс. Тем не менее можно выделить характерные синдромы.
- Клинически интоксикационный синдром проявляется в явлениях интоксикационной энцефалопатии, головных болях, тяжести в голове и тяжести общего состояния. Отмечаются диспепсические расстройства (сухость во рту, тошнота, рвота), тахикардия, иногда гипертензия (или гипотензия при начинающемся септическом шоке, что является одним из ранних его симптомов, наряду с цианозом и гиперемией лица на фоне резкой бледности) [4].
- Болевой синдром присутствует почти у всех больных и носит нарастающий характер, сопровождается ухудшением общего состояния и самочувствия, отмечается болезненность при специальном исследовании и симптомы раздражения брюшины вокруг пальпируемого образования. Пульсирующая нарастающая боль, сохраняющаяся лихорадка с температурой тела выше 38°С, тенезмы, жидкий стул, отсутствие четких контуров опухоли, неэффективность лечения — все это свидетельствует об угрозе перфорации или о наличии ее, что является абсолютным показанием для срочного оперативного лечения.
- Инфекционный синдром присутствует у всех больных, проявляется у большинства из них высокой температурой тела (38°С и выше), тахикардия соответствует лихорадке, так же как и нарастание лейкоцитоза, повышаются СОЭ и лейкоцитарный индекс интоксикации, снижается число лимфоцитов, нарастает сдвиг лейкоцитарной формулы влево, нарастает число молекул средней массы, отражающих нарастающую интоксикацию.
- Нередко страдает функция почек из-за нарушения пассажа мочи.
- Метаболические нарушения проявляются в диспротеинемии, ацидозе, электролитных нарушениях, изменениях в антиоксидантной системе.
Стратегия лечения данной группы больных строится на органосохраняющих операциях, но с радикальным удалением основного очага инфекции. Поэтому у каждой конкретной больной и время операции, и выбор ее объема должны быть оптимальными. Уточнение диагноза иногда занимает несколько суток, особенно при дифференциации с онкологическим процессом. На каждом этапе лечения требуется антибактериальная терапия [1, 2].
Предоперационная терапия и подготовка к операции включают:
- антибиотики (используют цефоперазон 2,0 г/сут, цефтазидим 2,0–4,0 г/сут, цефазолин 2,0 г/сут, амоксициллин + клавулановая кислота 1,2 г внутривенно капельно 1 раз в сутки, клиндамицин 2,0–4,0 г/сут и др.). Их обязательно сочетают с гентамицином по 80 мг внутримышечно 3 раза в сутки и инфузией метронидазола по 100 мл внутривенно 3 раза;
- дезинтоксикационную терапию с инфузионной коррекцией волемических и метаболических нарушений;
- обязательную оценку эффективности лечения по динамике температуры тела, перитонеальных симптомов, общего состояния и показателей крови.
Хирургический этап включает также продолжающуюся антибактериальную терапию. Особенно целесообразно введение одной суточной дозы антибиотиков на операционном столе, сразу после окончания операции. Эта концентрация является необходимой и создает барьер для дальнейшего распространения инфекции, так как проникновению в зону воспаления уже не препятствуют плотные гнойные капсулы тубоовариальных абсцессов. Хорошо проходят эти барьеры b-лактамные антибиотики (цефоперазон, цефтриаксон, цефтазидим, цефотаксим, имипинем/циластатин, амоксициллин + клавулановая кислота).
Послеоперационная терапия включает продолжение антибактериальной терапии теми же антибиотиками в сочетании с антипротозойными, антимикотическими препаратами и уросептиками. Курс лечения назначается в соответствии с клинической картиной, лабораторными данными; он не должен быть прекращен ранее чем через 7–10 дней. Инфузионная терапия должна быть направлена на борьбу с гиповолемией, интоксикацией и метаболическими нарушениями. Очень важна нормализация моторики желудочно-кишечного тракта (стимуляция кишечника, гипербарическая оксигенация, гемосорбция или плазмаферез, ферменты, перидуральная блокада, промывание желудка и т. д.). Гепатотропная, общеукрепляющая, антианемическая терапия сочетается с иммуностимулирующей терапией (ультрафиолетовое облучение, лазерное облучение крови, иммунокорректоры) [2, 9, 11].
Все больные, перенесшие оперативное вмешательство по поводу гнойных тубоовариальных абсцессов, нуждаются в постгоспитальной реабилитации с целью восстановления функции органа и профилактики.
Литература
- Абрамченко В. В., Костючек Д. Ф., Перфильева Г. Н. Гнойно-септическая инфекция в акушерско-гинекологической практике. СПб., 1994. 137 с.
- Башмакова М. А., Корхов В. В. Антибиотики в акушерстве и перинатологии. М., 1996. С. 6.
- Бондарев Н. Э. Оптимизация диагностики и лечения смешанных сексуально-трансмиссионных заболеваний в гинекологической практике: автореф. дис. . канд. мед. наук. СПб., 1997. 20 с.
- Венцела Р. П. Внутрибольничные инфекции. М., 1990. 656 с.
- Гуртовой Б. Л., Серов В. Н., Макацария А. Д. Гнойно-септические заболевания в акушерстве. М., 1981. 256 с.
- Кейт Л. Г., Бергер Г. С., Эдельман Д. А. Репродуктивное здоровье. Т. 2: Редкие инфекции. М., 1988. 416 с.
- Краснополъский В. И., Кулаков В. И. Хирургическое лечение воспалительных заболеваний придатков матки. М., 1984. 234 с.
- Корхов В. В., Сафронова М. М. Современные подходы к лечению воспалительных заболеваний вульвы и влагалища. М., 1995. С. 7–8.
- Кьюмерле X. П., Брендел К. Клиническая фармакология при беременности/ под ред. X. П. Кьюмерле, К. Брендела: пер. с англ: в 2 т. М., 1987. Т. 2. 352 с.
- Серов В. Н., Стрижаков А. Н., Маркин С. А. Практическое акушерство: руководство для врачей. М., 1989. 512 с.
- Серов В. Н., Жаров Е. В., Макацария А. Д. Акушерский перитонит: Диагностика, клиника, лечение. М., 1997. 250 с.
- Стрижаков А. Н., Подзолкова Н. М. Гнойные воспалительные заболевания придатков матки. М., 1996. 245 с.
- Хаджиева Э. Д. Перитонит после кесарева сечения: учеб. пособие. СПб., 1997. 28 с.
- Sahm D. E. The role of automation and molecular technology in antimicrobial susceptibility testing // Clin. Microb. And Inf.1997. 3; 2: 37–56.
- Snuth C. B., Noble V., Bensch R. et al. Bacterial flora of the vagina during the mensternal cycle // Ann. Intern.Med. 1982: 948–951.
- Tenover F. C. Norel and emerging mechanisms of antimicrobial resistance in nosocomial pathogens// Am. J. Med. 1991; 91: 76–81.
В. Н. Кузьмин, доктор медицинских наук, профессор
МГМСУ, Москва
Источник
В чем трудность лечения флегмон и абсцессов? Почему нецелесообразно применять мази на вазелиново-ланолиновой основе? Какие местные препараты соответствуют современным представлениям о лечении флегмон и абсцессов? Несмотря на активное внедрение
ФЛЕГМОНЫ И АБСЦЕССЫ — современные возможности лечения
В чем трудность лечения флегмон и абсцессов? Почему нецелесообразно применять мази на вазелиново-ланолиновой основе? Какие местные препараты соответствуют современным представлениям о лечении флегмон и абсцессов? Несмотря на активное внедрение
В чем трудность лечения флегмон и абсцессов?
Почему нецелесообразно применять мази на вазелиново-ланолиновой основе?
Какие местные препараты соответствуют современным представлениям о лечении флегмон и абсцессов?
Несмотря на активное внедрение в клиническую практику новых групп антибиотиков, проблема профилактики и лечения гнойно-септических осложнений в хирургии по-прежнему актуальна. Так, согласно литературным данным, частота гнойно-воспалительных осложнений после грыжесечений достигает 28,3%, после резекций желудка — 28,4%, холецистэктомий — 32%, аппендэктомий — 40,4%, панкреатитов — 50% (Прискарь В. И., 1999).
Летальность при перитоните колеблется от 16 до 80% (Даценко Б. М. с соавт., 1998, Гельфанд Б. М. с соавт., 1999, Камзакова Н. И., 2000).
В структуре внутрибольничных инфекций послеоперационные инфекции составляют 12,2%, а постинъекционные инфекции — 17%. Необходимо отметить, что процент тяжелых последствий внутрибольничных инфекций практически одинаков для хирургических стационаров и амбулаторно-поликлинических учреждений — 15,2% и 15,6% соответственно.
Особую тревогу вызывают случаи запоздалой диагностики осложненного течения абсцессов или флегмон. Так, например, в зависимости от локализации первичного гнойного процесса могут формироваться тяжелые гнойные артриты (после внутрисуставного введения гормональных, обезболивающих препаратов), тромбофлебиты (после внутрисосудистого введения различных лекарственных средств) с последующей генерализацией инфекционного процесса, с формированием гнойных очагов во внутренних органах (в сердце, легких, почках).
Ретроспективный анализ тяжелых абсцессов и флегмон, осложнившихся сепсисом после длительного консервативного или недостаточно активного хирургического вмешательства, показывает, что одной из основных причин возникновения осложнений можно считать недостаточное внимание к ранней диагностике формирующихся абсцессов и флегмон различной локализации, предполагающей использование современных неинвазивных методов исследования (ультразвука, компьютерной томографии), а также инвазивных диагностических методов, и прежде всего диагностической пункции области инфильтрата. Особую тревогу вызывает так называемая выжидательная тактика, когда, выполнив диагностическую пункцию и удалив некоторое количество гноя, хирурги пытаются дренировать гнойную полость с помощью резиновой трубки и назначают какой-либо антибактериальный препарат.
Радикальные оперативные вмешательства на уже сформированном гнойном очаге выполняются слишком поздно, дренирование послеоперационной раны бывает, как правило, неадекватным.
Кроме того, не уделяется должного внимания проблеме асептики и антисептики при оказании помощи пострадавшим, а также при выполнении различных диагностических и лечебных манипуляций как на амбулаторно-поликлиническом, так и стационарном этапах лечения. Использование традиционных антисептиков в данных ситуациях, к сожалению, не предупреждает развитие инфекционного процесса, так как проблема устойчивости микроорганизмов в равной степени актуальна как для группы антибактериальных препаратов, так и для традиционных антисептиков.
К примеру, чувствительность S.aureus, E.coli, B.fragilis к раствору фурациллина составляет менее 3, 1 и 3% соответственно. Массивность контаминации P.aeruginosa в растворе фурациллина может достигать 106 КОЕ/мл. Частота контаминации раствора фурациллина грибами достигает 58%.
В табл. 1 приводится далеко не полный перечень традиционных препаратов, от которых необходимо отказаться полностью и которые, тем не менее, используются как в домашних условиях, так и в медицинских учреждениях.
В данном сообщении приводится анализ результатов лечения 166 больных с постинъекционными флегмонами и абсцессами в специализированном отделении ран и раневой инфекции Института хирургии им. А. В. Вишневского РАМН. Больных, как правило, переводили из других хирургических стационаров ввиду прогрессирующего нарастания клиники интоксикации, с полиорганной недостаточностью, с сепсисом.
Возраст пациентов колебался от 18 до 84 лет. 124 больных были в возрасте от 30 до 60 лет. Длительность лечения на предыдущем этапе от начала формирования гнойного процесса составляла от 12 суток до 1,5 месяцев.
Сопутствующие заболевания: гипертоническая болезнь — 46 больных, остеохондроз тазобедренных суставов — 31 пациент, пояснично-крестцовый радикулит — 27 больных, почечная колика — 16 и другие заболевания — 46.
Гнойно-воспалительные процессы возникали после введения обезболивающих препаратов (анальгина, баралгина), гипотензивных (папаверина с дибазолом, магнезии), гормональных препаратов, кордиамина, масляных растворов витаминов, кокарбоксилазы и др.
Инфекционный процесс в 139 случаях возникал после инъекций, выполненных медицинскими работниками (бригады «скорой помощи», процедурные и хирургические кабинеты поликлиник, стационары). В остальных 27 случаях препараты вводились в домашних условиях не медицинскими работниками. Локализация абсцессов: в подавляющем большинстве случаев — это места внутримышечных инъекций (ягодичные области, реже — предплечья и места паранефральных, паравертебральных блокад).
 |
| Рис. 1 |
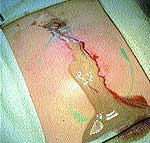
При первичном обращении больного за помощью по месту жительства в случае появления первых признаков формирования воспалительного процесса в качестве препаратов первой помощи использовались 3%-ный раствор йода («йодная сетка»), компрессы со спиртом, мазью Вишневского, ихтиоловой мазью. Консервативное медикаментозное лечение с подключением физиотерапевтических методов иногда продолжалось до 2–3 недель (рис. 1).
В дальнейшем, уже в условиях хирургических стационаров после хирургического вмешательства, послеоперационные раны тампонировались либо марлевыми тампонами, пропитанными 10%-ным раствором хлорида натрия, мазью Вишневского, раствором фурациллина, либо с дренирующей целью в раны устанавливались перчаточные резинки или резиновые трубки.
Такой метод лечения быстро приводил к распространению гнойного процесса за пределы первичной локализации, нарастанию интоксикации, развитию сепсиса.
Ввиду неэффективности лечения после развития септического состояния больные переводились для дальнейшего лечения в специализированное отделение гнойной хирургии им. А. В. Вишневского.
При поступлении практически все больные сразу помещались в блок интенсивной терапии отделения гнойной хирургии, где они получали необходимую пред- и послеоперационную корригирующую медикаментозную терапию.
В Институте хирургии им. А. В. Вишневского РАМН разработан метод активного хирургического лечения гнойных ран, основанный на следующих принципах:
- хирургическая обработка гнойного очага с тщательным удалением всех девитализированных тканей;
- использование дополнительных методов обработки послеоперационной раны (пульсирующая струя, ультразвуковая кавитация, криовоздействие, вакуумирование и др.);
- дренирование раны с помощью перфорированного силиконового дренажа с последующим длительным промыванием раны растворами антисептиков;
- раннее закрытие послеоперационной раны с помощью первичных, первичных отсроченных, ранних вторичных швов, местными тканями или методом аутодермопластики;
- общая и местная антибактериальная терапия с учетом аэробного и анаэробного компонентов раневого процесса;
- назначение иммунных препаратов по данным лабораторного контроля иммунологических показателей.
Использование вышеперечисленных дополнительных методов воздействия на раневую поверхность позволяет уменьшить обсемененность раневой поверхности патогенной флорой до уровня ниже «критического» — с 10 7-9 до 10 2-3 микробных тел в 1 г ткани раны.
Клинические примеры закрытия ран с помощью швов, дренирования и окончательный результат приведены на рис. 2, 3, 4.
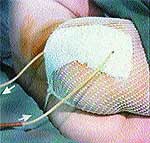 |
| Рис. 3 |
Во время поступления больного в отделение, а также в процессе лечения (во время перевязок, при повторных хирургических обработках ран, перед окончательным закрытием ран) проводятся бактериологические исследования видового состава ран. Результаты представлены в табл. 2.
Как видно из табл. 2, в подавляющем большинстве случаев из ран была выделена грамположительная микрофлора и в единичных случаях — ассоциация грамположительных и грамотрицательных микроорганизмов. Обращает на себя внимание достаточно большое число случаев выявления в ранах неклостридиальной анаэробной инфекции.
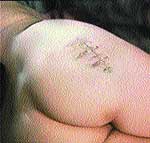 |
| Рис. 4 |
Все штаммы, выделенные из послеоперационных ран больных, ранее прооперированных в других лечебных учреждениях, были полирезистентны к традиционно используемым антибактериальным препаратам, что указывает на госпитальную принадлежность инфекции.
С учетом видового характера выделяемой из ран микрофлоры и чувствительности ее к антибактериальным препаратам назначались общая и местная антибактериальная терапии.
Наиболее часто (38,5%) использовались полусинтетические пенициллины (карбенициллин, ампиокс, диклоксациллин), в 15,7% случаев — аминогликозиды (гентамицин, тобрамицин, сизомицин, нетилмицин), в 12,5% — фторхинолоны (офлоксацин, пефлоксацин, ципрофлоксан), в 10,3% — цефалоспорины (цефотаксим, цефтазидим, цефтриаксон).
При обнаружении гнойно-воспалительного процесса, вызванного неклостридиальной анаэробной инфекцией (27 больных — 16,3%), как правило, назначалась комбинированная антибактериальная терапия — метронидазол с гентамицином или нетилмицином либо клиндамицин с гентамицином или нетилмицином. В последние годы в подобных ситуациях препаратом выбора считается имипенем, позволяющий активно воздействовать как на аэробный, так и анаэробный компонент микрофлоры ран. При локальном гнойном процессе, в случае выявления чувствительности стафилококков к фузидину, назначение этого препарата в комплексном лечении было также оправданно.
Выбор антисептиков, используемых для промывания ран
Как уже было сказано, использование раствора фурациллина в настоящее время нецелесообразно ввиду его крайне низкой антимикробной активности. В настоящее время перспективными можно считать растворы диоксидина, мирамистина, фурагина растворимого.
Прежде всего, очень важно следить за чистотой не только самой раны, но и окружающей рану кожи.
При выборе кожных антисептиков, используемых как с профилактической, так и лечебной целью, предпочтение отдается препаратам с универсальным, широким или умеренным спектром действия, активным против смешанной микрофлоры и обладающим микробоцидным или микробостатическим действием.
По-прежнему большой популярностью у медицинских работников пользуются препараты йода. Они обладают почти универсальным спектром активности: подавляют грамположительные бактерии, включая энтерококки и микобактерии, грамотрицательные бактерии, в том числе псевдомонады, ацинетобактерии, клебсиеллы, протей, споры бактерий, грибы, вирусы, включая вирусы гепатита В и С, энтеро- и аденовирусы, а также анаэробные, спорообразующие и аспорогенные бактерии.
1%-ный йодовидон, 1%-ный йодопирон — йодофоры, представляющие собой комплекс поливинилпиролидона с йодом. Различия между этими препаратами связаны со способом их получения, а также разной молекулярной массой поливинилпиролидона. Растворы йодовидона более стабильны при хранении, чем растворы йодопирона, готовящиеся обычно ex tempore. По степени бактерицидного действия эти препараты практически идентичны.
Сульйодопирон представляет собой пенистую жидкость, которая предназначена для мытья грязных инфицированных ран, лечения ран под повязкой, обработки рук хирурга и операционного поля. Сульйодопирон при местном применении оказывает бактерицидное действие.
Бактерицидный эффект при микробной нагрузке 106-107 бактерий на 1 мл среды наступает в течение 1-4 минут, превосходя по этим показателям растворы йодопирона.
1%-ный диоксидин обладает выраженной активностью против большинства аэробных, анаэробных и факультативно анаэробных патогенных бактерий.
К диоксидину чувствительны клинические штаммы бактерий с полирезистентностью к антибиотикам. Препарат используется для промывания и тампонирования гнойных ран, а также может вводиться внутривенно, внутриартериально, интратрахеально через катетер или ингаляционно, внутриплеврально, в брюшную полость через ирригаторы.
Наш 20-летний опыт применения диоксидина в комплексном лечении больных с сепсисом, перитонитом, медиастинитом, с развернутой клиникой интоксикации, прогрессирующей полиорганной недостаточностью не подтверждает мнение некоторых специалистов о высокой токсичности этого препарата. Строгое соблюдение правил введения, разовых, суточных и курсовых доз позволяет избежать таких нежелательных побочных явлений, как тошнота, рвота или судороги.
0,1%-ный фурагин (солафур) — антимикробное средство из группы нитрофуранов. Препарат преимущественно действует на грамположительную микрофлору. Его МПК в 10-20 раз ниже, чем у фурациллина. Используется либо внутривенно при тяжелых формах течения раневой инфекции, при инфекционном процессе в легких, органах мочевыводящих путей, либо местно в виде 0,1%-ного раствора при лечении ран, инфицированных стафилококками, а также для промывания мочевого пузыря.
0,01%-ный мирамистин (миристамидопропилдиметилбензиламмоний хлорид) — новый антисептик из группы катионных ПАВ.
Мирамистин характеризуется широким спектром антимикробных свойств. Препарат губительно действует на грамположительные, грамотрицательные бактерии, грибы, вирусы, простейшие, аэробные и анаэробные, спорообразующие и аспорогенные микроорганизмы в виде монокультур и микробных ассоциаций, включая госпитальные штаммы с полирезистентностью к лекарственным препаратам.
0,01%-ный водный раствор мирамистина с профилактической и лечебной целью используется в хирургии, травматологии и комбустиологии при незначительном количестве гнойного отделяемого в ране. Препаратом орошают поверхность ран и ожогов, рыхло тампонируют раны и свищевые ходы, марлевыми тампонами, смоченными антисептиком, промывают брюшную полость, вводят в плевральную полость и мочевой пузырь.
При обильной гнойной экссудации использование марлевых тампонов с растворами антисептиков для местного лечения ран неоправданно, так как тампоны, помещаемые в рану, быстро высыхают и, следовательно, не обладают необходимой для удаления гноя длительной осмотической активностью. В крайнем случае, рана может заполняться комбинированным тампоном — в центр марлевого тампона помещается силиконовая трубка, через которую 2-3 раза в сутки шприцем в рану вводится антисептик по 10-20 мл. Вместо 10%-ного раствора хлорида натрия для тампонирования послеоперационных ран в настоящее время используются современные мази на водорастворимой основе, высокую клиническую значимость которых можно считать доказанной.
Возможности использования мазей
К сожалению, до сих пор в ряде клиник используются мази на жировой основе с антибиотиками: линимент синтомицина, тетрациклиновая, эритромициновая и др. Однако мази на жировой основе с антибиотиками оказывают только кратковременное действие, поскольку вазелин-ланолиновая основа нарушает отток раневого отделяемого, не обеспечивает достаточного высвобождения активного ингредиента из композиции, не способствует проникновению антибиотика в глубь тканей, где находятся микробы, что приводит к переходу острых воспалительных заболеваний в хронические. Ввиду формирования в стационарах высокорезистентных штаммов микроорганизмов практически полностью утратили свою клиническую значимость и ихтиоловая мазь, и мазь Вишневского.
В последние годы в клиническую практику лечения гнойных ран в первой фазе раневого процесса внедрены новые мази — на полиэтиленоксидной основе (комбинации полиэтиленоксидов с молекулярным весом 400 и 1500).
Полиэтиленоксиды являются производными окиси этилена и обладают низкой токсичностью и выраженными осмотическими свойствами. При создании препаратов для лечения гнойных ран чаще всего используются полиэтиленоксид с молекулярным весом 400 (ПЭО-400) и полиэтиленоксид с молекулярным весом 1500 (ПЭО-1500).
В гнойной ране ПЭГ-1500 активно связывает воспалительный экссудат, отдавая его в повязку, с которой жидкость испаряется, а освободившиеся молекулы ПЭГ-1500 вновь присоединяют к себе экссудат, накапливающийся на дне раны.
Более мелкие молекулы (ПЭГ- 400) способны проникать в глубь тканей. Образуя с антибиотиком комплекс, ПЭГ-400 проводит его в ткани раны, где локализуются микробы. Этим он принципиально отличается от мазей на ланолин-вазелиновой основе, которые способны оказывать антимикробное действие только кратковременно и только на поверхности раны.
В состав современных мазей на полиэтиленоксидной основе введены различные антимикробные препараты:
- левомицетин (левосин, обладающий не только антибактериальным и противовоспалительным действием, но и благодаря входящим в него метилурацилу и тримекаину регенерирующим, некролитическим и анальгезирующим эффектами, что существенно облегчает состояние больного);
- диоксидин (5%-ная диоксидиновая мазь, диоксиколь, метилдиоксилин);
- йод с поливинил-пиролидоном (1%-ная йодопироновая мазь, йодметриксид);
- метронидазол + левомицетин (метрокаин);
- нитазол (стрептонитол, нитацид);
- фурациллин (фурагель);
- хинифурил (0,5%-ная мазь хинифурила);
- мафенид ацетат (10%-ная мазь мафенида-ацетата).
Кроме того, в состав мазей введены такие препараты, как тримекаин, имеющий обезболивающий эффект, и метилурацил, обладающий анаболической и антикатаболической активностью, в целях стимуляции процессов клеточной регенерации.
Все мази на основе ПЭО отличаются от традиционных препаратов прежде всего многонаправленностью действия — осмотический эффект наблюдается до 18 часов, что позволяет делать перевязки только один раз в сутки, в то время как при использовании 10%-ного хлорида натрия повторные перевязки необходимо выполнять через каждые 3-4 часа, в противном случае повязка, пропитанная раствором и раневым отделяемым, полностью теряет осмотическую способность.
Еще одно преимущество мазей на полиэтиленоксидной основе — это широкий спектр антимикробной активности.
Причем по эффективности воздействия в силу однотипности мазевой основы все мази практически равноценны. При создании новых мазей особое внимание уделялось их антибактериальной активности. А. В. Вишневский по этому поводу писал: «Мы интересуемся силой, степенью бактерицидных свойств мази, ибо снизить, сбить, уничтожить инфекцию в ране всегда является задачей необходимой и благодарной» (Вишневский А. В., 1937).
Антимикробная активность новых мазей в отношении S.aureus находится на уровне 86-97,3%, Е. coil — 71-97%, Р.aeruginosa — 64-90,8%, Proteus spp. — 76-100%.
Для подавления в ранах грамотрицательных бактерий, в частности синегнойной палочки, широко применяется 10%-ная мазь мафенида-ацетата на гидрофильной основе.
Несмотря на интенсивное применение мазей, содержащих левомицетин или диоксидин, их высокая антимикробная активность сохраняется на протяжении более 20 лет, что указывает на слабый процесс нарастания резистентности госпитальных штаммов.
С внедрением полиэтиленгликолевой основы в технологию создания новых лекарственных форм появилась возможность создать мази с нитрофурановыми соединениями. На их основе выпускаются две мази: 0,5%-ная мазь хинифурила, а также фурагель, где в качестве основы использован сополимер акриловой кислоты (СОКАП) и ПЭГ-400.
Новые отечественные мази, содержащие нитрофурановые соединения, показывают высокую клиническую и бактериологическую эффективность. Так, фурагель более активен (94%) при наличии в ране S.aureus и менее активен (79%) при Р.aeruginosa. Maзь хинифурила одинаково высоко активна при наличии в ране грамположительной и грамотрицательной микрофлоры (87-88%). Оба препарата хорошо переносятся даже в случае их длительного использования при лечении трофических язв. Применение сополимера акриловой кислоты с полиэтиленгликолем в различных весовых соотношениях в качестве мазевой основы позволяет регулировать осмотическую активность мази как в сторону ее повышения, так и снижения, что очень важно при переходе раневого процесса во вторую фазу и необходимости продолжения лечения раны под повязкой.
Клиническая эффективность 1%-ной йодопироновой мази и многокомпонентной йодсодержащей мази (йодметриксилена) в качестве лечебного средства составляет 92,6-93,4%. Бактериологическая активность этих двух препаратов была одинаково высокой (91,8-92,6%) в отношении всех основных возбудителей острых гнойных процессов мягких тканей. Побочные эффекты (клинически значимые) наблюдались в 0,7% случаев и клинически незначимые — в 2,3% случаев. Следует особо подчеркнуть высокую эффективность этих препаратов при лечении ран с грибковым поражением, что часто наблюдается у больных ослабленных, с обширными ожоговыми ранами, трофическими язвами, пролежнями.
В настоящее время в клиническую практику внедрены только зарубежные йодсодержащие мази (повидон-йод и бетадин), хотя отечественный аналог был разработан более десяти лет назад.
Установлено, что уровень обсемененности ран аэробной микрофлорой при лечении мазями на ПЭГ-основе опускается «ниже критического» к 3-5-м суткам. Появление грануляций в среднем достигается к 4-м суткам, начало эпителизации — к 5-м.
Широкий спектр антимикробной активности мазей на полиэтиленгликолевой основе, их высокая и длительная осмотическая активность позволяют более чем в 80% случаев в течение 4-5 суток купировать острый гнойный процесс и закончить лечение неосложненных гнойных ран мягких тканей наложением первично-отсроченных швов, тогда как при использовании гипертонического раствора хлорида натрия в 90% случаев только в конце 2-3-й недели лечения под прикрытием системной антибактериальной терапии удается закрыть рану путем наложения вторичных швов.
Для лечения неспорогенной анаэробной инфекции наряду с диоксидином перспективные возможности открылись после изучения препарата нитазола, показавшего высокое антибактериальное действие на стафилококки, стрептококки, кишечную палочку, аэробные спорообразующие бактерии, патогенные анаэробные микроорганизмы как клостридиальные, так и неклостридиальные в виде монокультур и микробных ассоциаций. По спектру антибактериального действия нитазол имеет преимущества перед метронидазолом, к которому нечувствительны стафилококки, кишечная палочка, стрептококки. Нитазол оказывает противовоспалительное действие, являясь нестероидным противовоспалительным средством.
На основе нитазола были созданы пенообразующий аэрозоль «Нитазол» и две многокомпонентные мази «Стрептонитол» и «Нитацид». По антимикробной активности стрептонитол и нитацид значительно превосходят зарубежный препарат «Клион» (Венгрия), в состав которого входит метронидазол. Осмотическая активность стрептонитола гораздо ниже, чем у нитацида, что обусловлено введением в его состав вазелинового масла с водой. И стрептонитол, и нитацид, созданные для лечения ран с неклостридиальной анаэробной инфекцией, обладают равнозначным широким спектром антимикробной активности как в отношении грамположительной, так и грамотрицательной микрофлоры (84,2-88,5%). Обращает на себя внимание высокая активность этих препаратов при наличии в ране Р.aeruginosa (86,3-91,1%). Обе позиции показывают хорошую клиническую эффективность при наличии в ране анаэробной инфекции (88-89%).
Различие в осмотической активности позволяет использовать эти препараты ступенчато — сначала нитацид (с высокой осмотической активностью), затем стрептонитол.
Специалисты, занимающиеся лечением гнойных ран, хорошо знают, что бывают ситуации, когда одного скальпеля для полного удаления некротических тканей недостаточно: необходимы протеолитические препараты.
В настоящее время доказана высокая клиническая эффективность комплексного ферментного препарата «Протогентин», содержащего фермент природного происхождения «протеаза С» с протеолитическим действием, антибиотики (гентамицин и эритромицин), консерванты.
Мазевая основа препарата состоит из полиэтиленоксида с вазелиновым маслом. Умеренная осмотическая активность обеспечивает удаление из раны гноя.
Протогентин, наиболее активный в отношении P.aeruginosa и Е.coli, подавляет рост 83,4-90,4% штаммов.
Антимикробные компоненты мази «Протогентин» хорошо проникают под струп раны, вследствие чего в тканях раны создаются концентрации, намного превышающие МПК.
Достаточная осмотическая активность, широкий спектр антимикробной активности, хорошие фармакокинетические свойства протогентина способствуют сокращению сроков некролизиса. Мазевая основа не повреждает грануляционную ткань, что позволяет использовать этот препарат в течение длительного времени, пока требуется ферментативная очистка раневой поверхности.
После очищения раны от гнойно-некротического содержимого и достижения ее бактериологической санации наступает вторая фаза раневого процесса. Этот период характеризуется появлением в ране островков грануляционной ткани, которая, развиваясь, покрывает раневую поверхность полностью. Здоровая грануляционная ткань всегда яркая, сочная, легко кровоточит. При малейшем ухудшении процессов биосинтеза в ране изменяется внешний вид грануляций: они теряют яркую окраску, становятся мелкими, покрываются слизистым налетом. Одной из причин такого осложнения считается суперинфекция. Всякое замедление развития грануляций ведет к задержке и остановке процесса эпителизации.
Большое значение для скорейшего заживления ран во второй фазе имеет способность препаратов, используемых для местного лечения, оказывать бактерицидное действие в целях предупреждения вторичной инфекции, защитить грануляционную ткань от механических повреждений, а также оказывать умеренное влагопоглощающее действие и стимулировать рост грануляций.
Оптимальный вариант — сочетание этих факторов в одном препарате. К таким препаратам относятся современные комбинированные мази на регулируемой осмотической основе: метилдиоксилин, стрептонитол, а также пенные аэрозоли «Cульйодовизоль», «Гипозоль-АН», раневые покрытия на основе натриево-кальциевой соли альгиновой кислоты, масла, аэрозоли, гидроколлоидные покрытия (табл. 3).
Мазь «Метилдиоксилин» — многокомпонентная мазь, содержит диоксидин, метилурацил и гидрофобную эмульсионную основу с наличием касторового масла. Композиция винилина с эмульгатором и ПЭГ-400 в качестве основы мази позволила снизить осмотическую активность этого препарата до такого уровня, чтобы новая мазь не пересушивала молодую грануляционную ткань.
Мазь «Стрептонитол» содержит антибактериальные вещества стрептоцид и нитазол на гидрофильной эмульсионной основе, которая оказывает слабое осмотическое действие, удаляя избыток влаги, и одновременно защищает грануляционную ткань от механических повреждений. Препарат показан для лечения во второй фазе воспаления ранее инфицированных анаэробной, грамположительной и грамотрицательной микрофлорой ран при наличии ярких сочных грануляций.
Аэрозоли
На переходном этапе первой фазы раневого процесса во вторую высокую клиническую эффективность показывают современные пено- и пленкообразующие аэрозоли. Пенные препараты в аэрозольной упаковке перспективны для профилактики и лечения гнойных осложнений. Это обусловлено тем, что пены создают барьер для инфицирования ран, они не обладают «парниковым эффектом»; небольшим количеством препарата в составе пены можно покрывать большие по площади раневые поверхности и заполнять объемные раневые каналы и «карманы». Преимуществом аэрозольной формы является быстрота обработки, что важно при массовом поступлении пострадавших. Аппликации пен атравматичны.
В настоящее время создан ряд пенных препаратов:
- диоксизоль (диоксидин);
- сульйодовизоль (йодовидон);
- сульйодопирон (йодопирон);
- нитазол (нитазол);
- цимезоль (циминаль + тримекаин + порошок окисленной целлюлозы);
- гипозоль-АН (нитазол + аекол + метилурацил).
В состав современных пенных препаратов обязательно входит какое-нибудь антимикробное средство, действующее на аэробную или на анаэробную микрофлору, включая неклостридиальную (бактероиды, пептококки, пептострептококки). Чаще всего используются диоксидин, йодовидон, циминаль и нитазол. Исследования антибактериальных свойств этих препаратов на моделях гнойных ран, вызванных анаэробной инфекцией, показывают выраженный терапевтический эффект, заключающийся в снижении высеваемости бактерий из ран к 3-5-му дню лечения до 10 1-2 микробов на 1 г ткани, уменьшении отечности и гиперемии, прекращении гнойной экссудации и в дальнейшем в заживлении ран.
Цимезоль кроме антисептика циминаля содержит анестетик тримекаин и гемостатик — порошок окисленной целлюлозы. Антисептическое действие циминаля усиливается благодаря сочетанию с димексидом и 1,2-пропилен-гликолем, которые обеспечивают проникновение циминаля в зоны некрозов и умеренный осмотический эффект.
Диоксизоль приготовлен на высокоосмотичной основе, а дегидратирующее действие диоксипласта сведено до минимума. Это определяет их применение соответственно в первой и во второй фазах раневого процесса при отсутствии в ранах большого количества гнойного отделяемого. Изучение антимикробной активности нового аэрозоля-диоксизоля показало преимущество этого препарата в случае выявления в ранах грамотрицательной микрофлоры. Диоксизоль подавляет Ps.aeruginosa в 92,5%.
Сульйодовизоль — пенообразующий аэрозольный препарат, расширяет возможности лечения ран йодовидоном в хирургии. Препарат показан для лечения ран во второй фазе раневого процесса, ранее инфицированных грамположительной и грамотрицательной аэробной микрофлорой.
Широкие клинические исследования показали необходимость использования пенообразующих аэрозолей только при отсутствии выраженного гнойно-воспалительного процесса на этапах подготовки раны к ее закрытию швами или методом пластики.
Масла
В настоящее время для лечения ран широко используются различные масла, в том числе и растительного происхождения (масло облепихи, масло шиповника, просяное масло — милиацил). Первые публикации о применении с этой целью различных масел относятся к эпохе Возрождения (Джованни де Виго, 1460-1520, Ambroslse Pare, 1510-1590).
Сравнительные экспериментальные исследования показали, что просяное масло прежде всего обладает более широким антимикробным спектром действия по сравнению с маслом шиповника или облепихи.
Просяное масло (милиацил) имеет высокое кислотное число (151,5-178,3), обусловленное большим содержанием свободных, ненасыщенных жирных кислот (олеиновой, линолевой, линоленовой). Этим объясняются стерильность препарата и его достаточный антимикробный эффект. Кроме того, входящее в состав просяного масла сложное стероидное соединение — пентациклический тритерпеноид — милиацин — обладает анаболическим действием и является стабилизатором мембран. Стабилизируя лизосомальные мембраны, милиацин предохраняет их от действия мембраноповреждающих факторов, например токсинов. В связи с этим уменьшается активность катепсинов, кислых РНК-азы и ДНК-азы, что приводит к уменьшению экссудации ткани, гипоксии, деполяризации РНК и ДНК.
Раневые покрытия
Широкие возможности в местном медикаментозном лечении ран открылись с появлением различных раневых покрытий, обладающих такими ценными качествами, как антимикробная активность, способность надежно предупреждать реинфицирование раневой поверхности, способность обеспечивать локальный гемостаз, ускорять образование грануляций, эпидермиса и активно поглощать раневой экссудат. Кроме того, современные раневые покрытия активно стимулируют образование грануляций и эпидермиса. При смене повязок эти препараты не вызывают болезненных ощущений. При длительном нахождении раневых покрытий на ране не возникает неприятного запаха.
В целях стимуляции процессов регенерации в ране наиболее широко используются перевязочные средства на основе производных белков и полисахаридов. С учетом специфического воздействия коллагеновых соединений на репаративные процессы в ране, а также данных по эффективности полисахаридных соединений с позиций создания оптимальных условий для формирования грануляционной ткани и миграции эпителиальных клеток разработаны раневые покрытия на основе белково-полисахаридных комплексов и их композиций с лекарственными препаратами. В качестве полисахаридных соединений использованы растительный полисахарид (альгинат натрия) и полисахарид животного происхождения (хитозан).
Биологически активные стимулирующие раневые покрытия
Биологически активные стимулирующие раневые покрытия с антимикробным и местно-анестезирующим действием выпускаются в четырех вариантах:
- дигиспон А (коллаген + гелевин + диоксидин + анилокаин);
- альгикол-ФА (коллаген + альгинат + фурагин + анилокаин);
- коллахит-ФА (коллаген + хитозан + фурагин + анилокаин);
- анишиспон (коллаген + шиконин).
Перечисленные раневые покрытия благотворно влияют на течение регенераторных процессов в ране. Коллаген-альгинатные покрытия стимулируют рост грануляционной ткани, а коллаген-хитозановые — рост эпителиальных клеток.
В последние годы наибольшее распространение получили препараты на основе альгиновой кислоты и коллагена.
На основе смешанного натриево-кальциевой альгиновой кислоты созданы полифункциональные влагопоглощающие препараты для местного лечения ран во второй фазе (альгипор, альгимаф).
Стимулирующие раневые покрытия хорошо моделируются на различных участках тела, обеспечивают нормальный парообмен в ране, сорбируют избыток раневого экссудата, обладают пролонгированным антимикробным и обезболивающим действием, создают влажную среду, оптимальную для миграции эпителиальных клеток. Выход лекарственных средств из стимулирующих раневых покрытий осуществляется в течение 48-72 часов в зависимости от количества раневого экссудата в ране.
Все современные раневые покрытия обладают высокой антимикробной активностью за счет введенных в них противомикробных компонентов (сизомицин — в сипролине, мафенид-ацетат — в альгимафе, фурагин — в альгиколе АКФ и коллахите ФА).
Сравнительная оценка антибактериальной активности этих препаратов показывает, что элиминация S.aureus, Proteus spp. из ран быстрее происходит при использовании альгимафа и сипролина.
Гидроколлоиды
В последние годы за рубежом для лечения больных с длительно незаживающими ранами, трофическими язвами, пролежнями нашли применение гидроколлоидные лекарственные средства, в частности содержащие пектин — дуодерм (США), варигесив (США).
В НПО «Биотехнология» (Россия) совместно с Институтом хирургии им. А. В. Вишневского РАМН разработаны две гидроколлоидные лекарственные формы нового поколения на основе пектина: галактон — жидкий гидроколлоид, предназначенный для лечения длительно незаживающих глубоких ран мягких тканей с умеренным количеством гнойного отделяемого; галагран — сухой гидроколлоид (порошок) для лечения поверхностных ран мягких тканей, пролежней, трофических язв.
За счет введенного в состав диоксидина гидроколлоиды показывают лучшую активность по сравнению с другими препаратами в отношении P.auruginosa.
При сравнении гидроколлоидов (галаграна и галактона) с сорбентами (дежизаном и дебризаном) выявляется более широкий спектр положительных свойств гидроколлоидов. Прежде всего, гидроколлоиды стимулируют процессы регенерации и эпителизации, предупреждают реинфицирование раневой поверхности, поддерживают влажную среду под повязкой. Показатель сорбционной способности галаграна невысок: по воде — 3,56 г/г, по крови — 2,57 г/г; при этом верхний слой галаграна не смачивается модельными жидкостями на протяжении всего срока наблюдения (одни сутки).
Основное поглощение воды идет в течение 5 часов, далее наблюдается снижение количества сорбированной жидкости за счет подсыхания верхнего слоя и образования корочки, затрудняющей процесс дренирования. Частицы галаграна в контактном слое набухают, превращаясь в гелеобразную массу, которая равномерно растекается по ране.
По данным цитологического исследования, в первые трое суток использования галаграна в раневых отпечатках выявляется тенденция интенсивного формирования грануляционной ткани.
Учитывая природу биополимера, гидроколлоиды (галагран и галактон) целесообразно применять на стадии развития в ране репаративных процессов.
Гентацикол
Высокоэффективным препаратом для лечения длительно незаживающих ран, трофических язв, остеомиелита, диабетической стопы является препарат гентацикол — пролонгированная форма гентамицина на биодеградируемой (коллагеновой) основе.
Содержание антибиотика в биоптатах ран, получаемых от больных различных клинических групп, зависит от количества раневого отделяемого и скорости рассасывания коллагеновой основы.
Длительные и высокие концентрации гентамицина обнаруживаются при использовании гентацикола в лечении остеомиелита или в случаях окончательного закрытия швами остеомиелитической полости.
Гентацикол создает высокие концентрации гентамицина в тканях раны на протяжении 2 недель, причем эти концентрации намного превышают МПК основных возбудителей хирургической инфекции.
Биодеградируемая коллагеновая губка с гентамицином способствует купированию инфекционного процесса, активизирует пролиферацию всех клеточных элементов грануляционной ткани, усиливает коллагеногенез. Препарат может использоваться в ургентной хирургии в качестве местного гемостатика. Использование гентацикола в комплексном лечении различных ран позволяет сократить показания к проведению общей антибактериальной терапии с 16,6 до 5,5%; при этом в 98,2% случаев ранние реконструктивно-восстановительные кожно-пластические операции оказываются успешными.
Источник
ЦЕФАЗОЛИН-АКОС 1,0 N1 ФЛ от известного производителя "СИНТЕЗ ОАО" ✔️ Приятная стоимость на ЦЕФАЗОЛИН-АКОС 1,0 N1 ФЛ всего: 2764.00 тенге ? Заказывайте моментальную доставку по Казахстану — КЗ Аптека.COM
ЦЕФАЗОЛИН-АКОС 1,0 N1 ФЛ

Цефазолин-АКОС — цефалоспориновый антибиотик I поколения для паренте-рального применения. Действует бактерицидно, нарушая синтез клеточной стенки микроорганизмов. Имеет широкий спектр действия, активен в отноше-нии грамположительных (Staphylococcus spp., Staphylococcus aureus (не продуцирующие и продуцирующие пенициллиназу; в том числе Streptococcus pneumoniae), Corynebacterium diphtheriae, Bacillus anthracis) и грамотрицательных (Neisseria meningitidis, Neisseria gonorrhoeae, Shigella spp., Salmonella spp., Escherichia coli, Klebsiella spp., Treponema spp., Leptospira spp.) микроорганизмов. Активен в отношении Haemophilus influenzae, некоторых штаммов Enterobacter spp. и Enterococcus spp.
Не эффективен в отношении Pseudomonas aeruginosa, индолположительных штаммов Proteus spp., Mycobacterium tuberculosis, Serratia spp., анаэробных микроорганизмов, метициллин-устойчивых штаммов Staphylococcus spp.
Фармакокинетика
Время достижения максимальной концентрации (ТСmax) при внутримышечном введении в дозе 1 г — 1 ч; максимальная концентрация (Сmax) –64 мкг/мл; после внутривенного введения ТСmax – в конце инфузии, после внутривенного введения 1 г Cmax – 180 мкг/мл. Проникает в суставы, ткани сердечно-сосудистой системы, в брюшную полость, почки и мочевыводящие пути, плаценту, среднее ухо, дыхательные пути, кожу и мягкие ткани. В небольших количествах выделяется с грудным молоком. Концентрация в ткани желчного пузыря и желчи значительно выше, чем в сыворотке крови. При обструкции желчного пузыря концентрация в желчи меньше, чем в плазме. Объем распределения – 0.12 л/кг. Связь с белками плазмы – 85 %. Период полувыведения (Т1/2) при внутримышечном введении – 1.8 ч, при внутривенном введении – 2 ч. При нарушении функции почек Т1/2 – 20-40 ч.
Побочные действия
— головная боль, головокружение
— нарушение функции почек (у больных с заболеваниями почек при лечении большими дозами – 6 г)
— тошнота, рвота, диарея, боль в животе, псевдомембранозный энтероколит
— холестатическая желтуха, гепатит
— нейтропения, тромбоцитопения, тромбоцитоз, гемолитическая анемия
— суперинфекция, вызываемая устойчивыми к антибиотику штаммами, канди-дамикоз (в т.ч. кандидозный стоматит)
-гипертермия, кожная сыпь, крапивница, кожный зуд, бронхоспазм, эозинофилия, ангионевротический отек, артралгия, анафилактический шок, мультиформная экссудативная эритема (в т.ч. синдром Стивенса-Джонсона), токсический эпидермальный некролиз (синдром Лайелла)
— при внутримышечном введении – болезненность (в месте введения), при внутривенном введении — флебит
— положительная реакция Кумбса, повышение активности «печеночных» трансаминаз, гиперкреатининемия, увеличение протромбинового времени
Особенности продажи
Особые условия
С осторожностью использовать пациентам пожилого возраста и обращать особое внимание на дозы и интервалы между введениями доз.В связи со сниженными физиологическими функциями у пожилых пациентов, есть вероятность появления нежелательных явлений как потенциальное кровотечение, вызываемое дефицитом витамина К.
Пациенты, имевшие в анамнезе аллергические реакции на пенициллины, кар-бапенемы могут иметь повышенную чувствительность к цефалоспориновым антибиотикам.
При назначении препарата возможно обострение заболеваний ЖКТ, особенно колита.
Сообщалось, что почти все антибиотические средства, включая Цефазолин, могут вызывать псевдомембранный колит.Следовательно, потенциальный риск развития псевдомембранного колита необходимо учитывать в случае пациентов, у которых возникает диарея во время или после антибактериального лечения.
Цефалоспорины могут вызывать снижение протромбиновой активности.В группу риска входят пациенты с почечной или печеночной недостаточностью или плохим алиментарным статусом, а также пациенты, проходящие длительный курс антибактериальной терапии и пациенты, ранее стабилизировавшиеся на антикоагулянтной терапии.За протромбиновым временем необходимо наблюдать у пациентов группы риска.Экзогенный витамин К необходимо вводить согласно указаниям.
Цефазолин содержит натрий.Данный факт необходимо принимать во внимание в случае пациентов на контролируемой натриевой диете.
Хотя препарат может быть причиной получения ложноположительных результатов при определении глюкозы в моче во время испытаний, проводимых с таблетками Бенедикта, Фелинга или Клинитест, он не дал бы ложноположительных результатов при использовании ферментативного метода испытания.
Использование препарата может приводить к получению ложноположительных результатов прямого или непрямого антиглобулинового теста (проба Кумбса).В отношении новорожденных младенцев, чьи матери лечились цефалоспоринами до рождения ребенка, могут быть получены ложноположительные результаты пробы Кумбса.
В связи с тем, что безопасность использования у недоношенных детей и новорожденных не была установлена, применение препарата у данных пациентов не рекомендуется.
Особенности влияния лекарственных средств на способность управлять транспортным средством или потенциально опасными механизмами
- головокружение
- судороги
- тошнота
- рвота
- боль в животе
- в связи с этим на время лечения следует воздержаться от управления транспортным средством или потенциально опасными механизмами
Показания
- — острый и хронический бронхит
- инфицированные бронхоэктазы
- бактериаль-ная пневмония и бронхопневмония
- эмпиема и абсцесс легких
Противопоказания
— повышенная чувствительность к препаратам группы цефалоспоринов и другим беталактамным антибиотикам
— беременность и период лактации
— новорожденные (до 1 месяца)
Лекарственное взаимодействие
Антикоагулянты. Цефалоспорины могут в редких случаях привести к рас-стройствам коагуляции и кровотечению. Поэтому, когда вводятся антикоагу-лянты (например, варфарин или гепарин), следует контролировать показатели коагуляции.
Витамин К. Некоторые цефалоспорины, такие как цефамандол, цефазолин и цефотетан, нарушают обмен витамина К1, особенно в случаях дефицита вита-мина К1. Это может потребовать заместительной терапии витамином К1.
Пробенецид. Из-за его ингибирующего влияния на почечный диурез (канальцевую секрецию), применение пробенецида приводит к увеличению концентрации и времени удерживания Цефазолина в крови.
Аминогликозиды/Диуретики. Нельзя исключить, что Цефазолин усиливает действие нефротоксических аминогликозидов и быстродействующих диуретиков (например, фуросемид). Поэтому во время сопутствующей терапии этими препаратами рекомендуется контролировать функцию почек.
Ближайшие к вам пункты доставки в Алматы вы можете посмотреть здесь.
Дозировка
Внутривенно (струйно и капельно), внутримышечно.
Средняя суточная доза для взрослых – 1-4 г; кратность введения – 2-4 раза в сутки. Максимальная суточная доза – 6 г. Средняя продолжительность лечения составляет 7-10 дней.
Для профилактики послеоперационной инфекции — внутривенно, 1 г за 0.5-1 ч до операции, 0.5-1 г – во время операции и по 0.5-1 г – каждые 8 ч в течение первых суток после операции.
Больным с нарушениями функции почек требуется изменение режима дозирования в соответствии со значениями клиренса креатинина (КК): при КК 55 мл/мин и более или при концентрации креатинина в плазме 1,5 мг% и менее можно вводить полную дозу; при КК 54-35 мл/мин или концентрации креатинина в плазме 3-1.6 мг% можно вводить полную дозу, но интервалы между инъекциями необходимо увеличить до 8 ч; при КК 34-11 мл/мин или концентрации креатинина в плазме 4.5-3.1 мг% — ? дозы с интервалами 12 ч; при КК 10 мл/мин и менее или при концентрации креатинина в плазме 4.6 мг% и более – ? обычной дозы каждые 18-24 ч. Все рекомендуемые дозы вводят после начальной дозы 0.5 г.
Детям 1 мес и старше – 25-50 мг/кг/сут; при тяжелом течение инфекции доза может быть увеличена до 100 мг/кг/сут. Кратность введения – 3-4 раза в сутки. У детей с нарушениями функции почек коррекцию режима дозирования проводят в зависимости от значений КК: при КК 70-40 мл/мин – 60 % от средней суточной дозы и вводят каждые 12 ч; при КК 40-20 мл/мин – 25 % средней суточной дозы с интервалом в 12 ч; при КК 5-20 мл/мин – 10 % средней суточной дозы каждые 24 ч. Все рекомендуемые дозы вводят после начальной дозы.
Для внутримышечного введения 0.5 г препарата растворяют в 2-3 мл изотонического раствора натрия хлорида или воды для инъекций, 1 г – в 4-5 мл изотонического раствора натрия хлорида или воды для инъекций. Полученный раствор вводят глубоко в мышцу.
Для внутривенного струйного введения разовую дозу препарата разводят в 10 мл изотонического раствора натрия хлорида 0.9 % и вводят медленно, в течение 3-5 мин.
При внутривенном капельном введении препарата (0.5 г и 1 г) разводят в 100-250 мл изотонического раствора натрия хлорида 0.9 % или раствора декстрозы 5 % и вводят в течение 20-30 минут (скорость введения 60-80 капель в 1 минуту).
Во время разведения флаконы необходимо энергично встряхивать до полного растворения.
Передозировка
Симптомы: сонливость, парестезии, головная боль, возможны судороги, осо-бенно у пациентов с почечной недостаточностью. Изменения лабораторных показателей при передозировке: повышение уровня креатинина в сыворотке крови, изменение функциональных печеночных тестов, положительная проба Кумбса, тромбоцитоз, тромбоцитопения, эозинофилия, лейкопения, удлинение протромбинового времени.
Лечение — симптоматическая терапия. В случае тяжелой передозировки, осо-бенно у больных с почечной недостаточностью, применяют гемодиализ и гемосорбцию.
Источник
В России к широкому применению разрешены 3 вакцины от коронавируса: «ЭпиВакКорона», «КовиВак» и «Спутник V». Все они изготовлены на разных технологических платформах, что позволяет врачам подобрать наиболее подходящую для каждого пациента.
Что еще важно знать про прививку «КовиВак»?
Вакцина разработана научным центром имени Чумакова РАН. Относится к классическому типу вакцин. Иммунологическая эффективность — 85%. В основе инактивированной вакцины настоящий COVID-19. Ученые в лаборатории убивают вирус и «отключают» у него возможность к размножению — он больше не способен причинить вред.
Но зато вызывает иммунный ответ: будто человек уже переболел. К «обезглавленному» вирусу добавляют адъювант — гидроокись алюминия. Вещество собирает на себе частицы вируса. Именно в этом виде вакцину вводят пациентам.
Серьезных побочных проявлений после вакцинации не выявлено. В редких случаях наблюдается уплотнение в месте укола. «КовиВак» рекомендуют пациентам в возрасте от 18 до 60 лет. Инактивированные вакцины изготавливают во всем мире вот уже несколько десятков лет. Это старая технология: в эффективности сомневаться не приходится. По подобной схеме создают вакцины от гриппа.
Инактивированные вакцины не противопоказаны людям с иммуносупрессивным или иммунодефицитным состоянием. В то же время у пациентов, использующих препараты, подавляющие иммунитет, может не развиться достаточный иммунный ответ. Поэтому прием подобных препаратов противопоказан как минимум один месяц до и после прививки. Однако корректировать медикаментозную терапию может только лечащий врач.
Сейчас стало приходить все больше информации о так называемом постковидном синдроме. Даже те, кто перенес болезнь в легкой форме, жалуются на нарушения в работе нервной системы, проблемы с легкими и сердцем, выпадение волос. Поэтому лучше не ставить эксперименты и не рисковать здоровьем, а привиться.
Источник


