Оглавление
Лихорадка от кошачьих царапин (фелиноз, доброкачественный лимфоретикулез, гранулема Молляре) – тяжелое заболевание инфекционного типа.
Болезнь кошачьих царапин

Лихорадка от кошачьих царапин (фелиноз, доброкачественный лимфоретикулез, гранулема Молляре) – тяжелое заболевание инфекционного типа. Появляется вследствие укусов или царапин кошек. Болезни свойственны воспаления регионарных лимфоузлов – изначально нагнаиваются папулы, иногда – возникает конъюнктивит, ангиоматоз, поражается печень. Отмечается лихорадка и общее отравление организма.
Источником возникновения является подвижная палочковидная бактерия. Средой ее обитания является ротовая полость млекопитающих. В основном кошек, собак, обезьян. Заболеванию чаще подвержены дети и молодые люди в возрасте до 20 лет. Инфекция попадает в организм при лизании, царапании, укусах через поврежденные кожные покровы. Часто – через царапины.
Именно поэтому фелиноз называют болезнью кошачьих царапин. Однако стоит помнить, что заразиться можно от любого млекопитающего, зараженного этой болезнью при попадании вирусной бактерии в организм человека.

Источник
Болезнь кошачьих царапин — что это такое? Все о заболевании: причины, симптомы, разновидности и варианты лечения заболевания!
Болезнь кошачьих царапин

Болезнь кошачьих царапин — это патологическое состояние, вызванное попаданием в организм человека инфекционного агента через укус животного или при наличии механического повреждения животным кожных покровов человека (царапин). Возбудителем болезни кошачьих царапин являются грамотрицательные бактерии рода Bartonella. Примечательно, что практически во всех случаях возникновения болезни кошачьих царапин, инфекция попадает в организм через повреждения кожи, наносимые маленькими котятами, а не взрослыми особями. Среди животных болезнь переносят блохи. Также бартонеллы встречаются у собак, птиц и грызунов. Когда бактериальный агент попадает в организм пациента через микротравмы кожных покровов или слизистую оболочку глаз, то возникает определенная реакция организма, носящая название «первичный инфекционный аффект».

Причины болезни кошачьих царапин
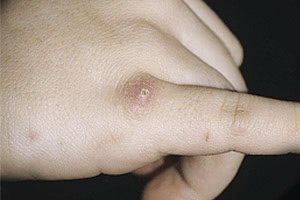
В организме человека после того, как проник возбудитель инфекции, возникает первичный аффект. Большое значение имеет изначальный очаг заражения, с которого идет весь инфекционный комплекс. Под первичным аффектом врачи понимают первые изменения, происходящие в той области кожных покровов или слизистых, где произошло инфицирование. Впрочем, под первичным аффектом понимают не только местные изменения, но и первичные явления общей интоксикации организма. В измененной ткани, как правило, можно обнаружить большое скопление патогенных микроорганизмов. Бактериальные агенты сохраняются в пораженной ткани достаточно длительное время, и если у пациента снижен иммунитет, то могут возникать обострения заболевания или его прогрессирование.
Из места первичного заражения по лимфатической системе возбудитель попадает в ближайшие (регионарные) лимфоузлы. Здесь инфекция активно размножается, а в процессе жизнедеятельности микроорганизмов вырабатываются токсические вещества, провоцирующие лимфаденит. В лимфоидной ткани сначала образуются гранулемы, а позже — микроабсцессы.
Факторы, предрасполагающие к развитию болезни кошачьих царапин, следующие:
- нарушения иммунных реакций на клеточном уровне различного генеза;
- ВИЧ-инфекция (особенно у пациентов, у которых наблюдается количество иммунных клеток СD4+ менее 100);
- злоупотребление алкоголем;
- длительный систематический прием некоторых лекарственных средств и т.д.
Симптомы болезни кошачьих царапин
Согласно варианту клинического течения заболевания принято выделять типичную и атипичную форму заболевания. Кроме того, заболевание имеет некоторую стадийность:
- инкубационный период;
- начальный период;
- разгар инфекционного процесса;
- период реконвалесценции (выздоровления).
Инкубационный период протекает у каждого пациента индивидуально и составляет от трех дней до двух месяцев. Для типичной формы болезни кошачьих царапин характерно наличие таких симптомов, как первичный аффект, описанный выше, лимфаденит и явления общей интоксикации (лихорадка). Окончание инкубационного периода характеризуется появлением в месте инфицирования характерных папул с ярко выраженной гиперемией (покраснением). Укус или царапина, как правило, к этому времени уже заживают, а потому пациенты не обращают особого внимания на появившееся уплотнение.
Через несколько дней папула преобразуется в пустулу. Это образование вскрывается и образует небольшое изъязвление. Кроме кожных проявлений наблюдается воспаление и увеличение в размерах ближайших лимфоузлов (подключичных, подмышечных, паховых, шейных или подчелюстных). Именно изменения со стороны лимфатической системы являются наиболее устойчивыми и сохраняются от двух недель до нескольких месяцев.
Период разгара заболевания характеризуется, кроме прочего, явлениями общей интоксикации организма. У пациента наблюдаются лихорадка, общее недомогание, слабость, боль в мышцах, потливость, тошнота и другие признаки. В этом периоде может наблюдаться увеличение печени пациента и его селезенки (отмечается при пальпации).
Атипичные формы заболевания встречаются значительно реже, но именно они могут давать тяжелые осложнения на многие органы и системы организма. К атипичным формам болезни кошачьих царапин относятся:
- Глазная форма патологии. Возникает при попадании слюны инфицированного животного непосредственно на конъюнктиву глаза. Характерными признаками такого поражения считается гранулематоз, отечность век и сильная гиперемия. Глаза пациента с трудом открываются, наблюдается воспаление околоушных и нижнечелюстных лимфоузлов.
- Нейроретинит. Клинически проявляется значительным снижением зрения одного глаза, что является следствием воспаления диска зрительного нерва. Не наблюдается изменений соматического состояния кроме снижения остроты зрения. На сетчатке можно наблюдать возникновение характерных узелков.
- Неврологическая атипичная форма. Проявляется в мышечной боли, спазмах, явлениях радикулита или миелита. Оболочки мозга в патологический процесс вовлекаются редко. Тем не менее, были отмечены случаи развития менингита и энцефалита. Эти явления развиваются спустя несколько недель после развития лимфаденита.
При атипичных формах заболевания страдают многие органы, но больше всех печень и селезенка. Зафиксированы случаи развития у пациентов эндокардита и других проявлений со стороны сердечно-сосудистой системы, а также остеомиелита и других осложнений.
Болезнь кошачьих царапин, симптомы которой различаются, как правило, проходит через 2-4 месяца при условии адекватной вспомогательной терапии.
Диагностика болезни кошачьих царапин
В большинстве случаев диагноз данного заболевания не представляет сложности. Прежде всего, следует обратить внимание на наличие контакта с кошкой, отмечаемое в 95% всех клинических случаев. Самым характерным признаком является регионарный лимфаденит. При этом остальные лимфатические узлы не воспалены и не увеличены.
Подтвердить диагноз врачу помогают лабораторные исследования: гистологические исследования биоптата, взятого из имеющихся папул и измененных лимфатических узлов. Также проводятся печеночные пробы, в которых выявляются характерные изменения, связанные с повышенными данными практически всех показателей. Информативными могут стать такие анализы, как ПЦР (полимеразная цепная реакция), РИФ (реакция иммунофлюоресценции) или ИФА (иммуноферментный анализ). Один из наиболее прогрессивных методов диагностики — кожные пробы на болезнь кошачьих царапин или фелиноз.
Требуется дифференциальная диагностика с лимфомой, гистоплазмозом, туляремией, лимфогранулематозом, соркоидозом, мононуклеозом инфекционной этиологии, токсоплазмозом, цитомегаловирусом и некоторыми другими заболеваниями.
Если заболевание имеет атипичную форму, то пациенту могут понадобиться консультации узких специалистов: дерматовенеролога, офтальмолога, невролога, кардиолога, пульмонолога и других. Болезнь кошачьих царапин, диагностика которой не представляет сложности, требует комплексного подхода к выбору методов лечения.
Профилактика и лечение болезни кошачьих царапин
Болезнь кошачьих царапин, лечение которой требуется лишь в тяжелых клинических случаях и при атипичных формах заболевания, часто заканчивается самоизлечением.
Для того чтобы ускорить процесс выздоровления, применяют антибактериальную терапию. Сегодня препаратом выбора многих врачей стал «Кетолид» — антибиотик, принадлежащий к группе макролидов. Также применяются другие антибиотики различных групп согласно назначению лечащего врача, нестероидные противовоспалительные препараты и антигистаминные лекарственные средства.

Если у пациента наблюдаются тяжелые осложнения со стороны лимфатических узлов, то могут быть показаны физиотерапевтические процедуры, а в некоторых случаях — вскрытие абсцесса с последующей аспирацией гнойного содержимого. По медицинским показаниям лимфатический узел может быть полностью удален хирургическим путем. При атипичных формах заболевания лечение назначают врачи узкого профиля в соответствии с имеющимися симптомами и клинической картиной течения заболевания.
Специфических профилактических мер по предупреждению болезни кошачьих царапин не существует. Хозяевам домашних питомцев рекомендуется своевременно обрабатывать животных от блох, обрезать им когти, а также соблюдать гигиену. При факте наличия царапины кошки, ее необходимо оперативно обработать любым антисептическим раствором.
Медицинский прогноз заболевания рассматривается как условно благоприятный. Пациенту необходимо своевременно обратиться к врачу, пройти обследование и соответствующее лечение с целью недопущения нежелательных осложнений, способных стать причиной состояний, угрожающих здоровью и жизни человека.
Введите ваши данные, и наши специалисты свяжутся с Вами, и бесплатно проконсультируют по волнующим вас вопросам.
Источник
Воспаление десен: под коронкой, возле одного или нескольких зубов, рядом с зубом мудрости – что делать. Причины воспаления и чем лечить: мази, гели, антибиотики и полоскание.
Причины воспалительных процессов в десне
Десенные заболевания развиваются по следующим причинам:
- Естественная микрофлора. Главный виновник болезни — бактерии в полости рта. В нормальных условиях микроорганизмы безопасны. Если иммунитет ослаблен сильным стрессом, несбалансированным питанием, химиотерапией, системными заболеваниями, развивается патогенная микрофлора. Она вызывает воспалительный процесс в мягких тканях десны.
- Неправильный уход за полостью рта. Из-за нерегулярной или неправильной чистки на зубах скапливается мягкий налет, который затвердевает и образуют зубной камень. Бактерии в зубном камне вызывают гингивит, а при отсутствии лечения — хронический пародонтит.
- Хроническое травмирование. Механическая травма возникает после ошибки в ходе ортопедической процедуры. Если кламмер протеза, нависающий край пломбы или коронки задевает мягкие ткани, десна начнет опухать. Пациент не обращает внимания на симптомы, потому что привыкает к ортопедической конструкции. Если не обратиться к стоматологу, начнутся патологии.
- Травматический прикус (окклюзионный контакт). Патология возникает, если зубы неравномерно смыкаются. Часть зубных единиц при жевании перегружаются, из-за чего в этой области челюсти воспаляется десневой край и разрушается костная ткань. Неправильный прикус может быть врожденным или приобретенным вследствие неплотного прилегания пломбы или коронки.
- Относительные причины. Воспалительные процессы мягких тканей активизируются на фоне снижения иммунитета при гормональных перестройках во время беременности, подросткового периода. Некоторые болезни также способствуют воспалению десен (диабет, аутоиммунные нарушения, заболевания ЖКТ). Курение тоже провоцирует воспалительные процессы из-за раздражения слизистой оболочки.
Консультация, снимок и план лечения бесплатно
Укажите свой номер телефона, мы перезвоним и подберём для вас удобное время приёма. Или позвоните нам сами — +7 495 401-68-55
Мы обязательно свяжемся с вами в ближайшее время и проконсультируем по всем имеющимся вопросам.
Нет времени ждать? Позвоните:

Источник
Клинические проявления аллергии на мясо включают IgE-опосредованные реакции и синдром «кошка–свинина». Для диагностики аллергии на мясо проводят аллергологическое обследование — кожные пробы и определение уровня специфических IgE. Наиболее чувствительным
Аллергия на мясо. Клинические случаи
Клинические проявления аллергии на мясо включают IgE-опосредованные реакции и синдром «кошка–свинина». Для диагностики аллергии на мясо проводят аллергологическое обследование — кожные пробы и определение уровня специфических IgE. Наиболее чувствительным
Clinical manifestations of allergy to meat include IgE-mediated reactions and cat-pork syndrome. For the diagnosis of аllergy to meat conduct skin tests and determining the level of specific IgE in blood. The most sensitive method is a prick-prick test including raw meat. Clinicians should be aware of allergic reactions to mammal meat that is essential for optimal therapy.
Несмотря на относительно высокий уровень потребления мяса, аллергические реакции на него наблюдаются сравнительно редко [1]. Аллергия на мясо встречается примерно у 3–15% детей и 3% взрослых пациентов с пищевой аллергией (ПА) [4]. Наиболее часто встречается аллергия на говядину, особенно среди детей, страдающих ПА к белкам коровьего молока (20%) и атопическим дерматитом (1,5–6,5%) [2]. Различия в распространенности реакций на тот или иной вид мяса связаны с географическим преобладанием их употребления в рационе питания людей [5, 6]. Так, описаны неблагоприятные реакции на другие виды мяса млекопитающих (например, кенгуру, кита), а также на мясо курицы и индейки.
Основными аллергенами говядины являются термолабильный бычий сывороточный альбумин (Bos d 6), в меньшей степени аллергизируют белки, производные мышц (актин, миозин и т. п.) [3]. Кроме того, как показали недавние исследования, у больных с аллергией на красное мясо может развиться замедленная анафилаксия, опосредованная специфическими IgE к гликопротеину — галактоза-альфа-1,3-галактозе (α-gal) [4–7]. По сути, открытие этих специфических эпитопов привело к появлению нового типа ПА, впервые описанного американскими учеными в 2009 г. [4]. Более того, α-gal позволил исследовать ряд новых аспектов аллергических заболеваний. Оказалось, что пациенты, сенсибилизированные к α-gal, чаще всего имели в анамнезе укус клещей, что указывало на возможную взаимосвязь между этим фактором и началом аллергии на красное мясо у взрослых [6]. Действительно, дальнейшие исследования подтвердили, что клещи (их слюна, кишечник) содержат α-gal, однако не ясно, является ли данный эпитоп общим для всех более чем 1000 разновидностей клещей, включая разные эндемические регионы [8]. Другой интересный факт: α-gal был обнаружен в противоопухолевом препарате цетуксимаб (в концентрации 10,2 мкг/5 мг), что являлось причиной развития анафилаксии сразу после первой внутривенной инъекции у
20% онкологических больных [9].
D. Apostolovic и соавт. обнаружили 7 новых α-gal-содержащих IgE-связывающих протеинов (М-креатинкиназа, аспартатаминотрансфераза, β-энолаза, α-энолаза и т. п.), из которых 4 оставались стабильными при обработке мяса [10]. Ламинин γ-1 и коллаген α-1 говядины являются α-gal-содержащими аллергенами, что объясняет перекрестную реактивность красного мяса с желатином.
α-gal содержат также другие протеины: фибриноген, IgG, фибронектин, тиреоглобулин, интегрин, однако его не обнаруживают в мясе домашних птиц и рыб [5]. Оказалось, что IgA кошки (Fel d 5) является аллергеном, который содержит α-gal [5].
Термическая и другие виды обработки разрушают протеины и модифицируют IgE-связывающие свойства из-за изменения конформации эпитопов. Это может приводить также к продукции новых эпитопов и тем самым повышению аллергенности продукта [11]. Известно, что некоторые пациенты отмечают реакции на вареное/жареное мясо одновременно [12].
Важно врачам и пациентам помнить также о перекрестной реактивности между продуктами (например, бычьим сывороточным альбумином и альбуминами коз и свиней) [13]. Перекрестная реактивность между альбумином кошки и свининой (синдром «свинина–кошка») была впервые описана еще в 1994 г. [14]. Реже встречаются аллергические реакции на желатин крупного рогатого скота и свиней [13]. Однако из-за перекрестной реактивности желатин, входящий в состав сладостей, лекарственных капсул и вакцин, может стать причиной аллергических реакций (вплоть до анафилаксии) у пациентов, страдающих ПА на мясо [13, 15]. Подобные случаи на коллоидные растворы предположительно объясняют сенсибилизацией больного не только к желатину, но и α-gal [15].
Диагностические критерии
Пациента с аллергией на мясо следует расспросить: о клинических симптомах заболевания; обязательно уточнить, бывал ли (или жил) в эндемичных районах, где обитают клещи; в случае укуса клещей — как протекали реакции на них и т. п. (табл. 1).
Как правило, аллергия на красное мясо чаще встречается среди детей, которые перерастают ее в течение первых лет жизни [1]. Напротив, аллергия на свинину у больных с аллергией на кошку возникает позже, часто в подростковом или зрелом возрасте, причем сенсибилизация к перхоти кошки предшествует развитию аллергии на свинину [6, 22]. Характерная особенность пациентов со специфическими IgE к α-gal — укус клеща в анамнезе (возможно, даже неоднократно) и клинические признаки, указывающие на замедленную анафилаксию.
Как обычно, обследование больных с подозрением на аллергию на мясо начинают с постановки кожных проб с использованием коммерческих экстрактов аллергенов мяса. Положительным считается результат при размере волдыря не менее 3 мм и отрицательном контроле через 15 минут. Однако прик-тесты с коммерческими экстрактами говядины, свинины или баранины чаще всего показывают небольшие волдыри (от 2 до 4 мм в диаметре), что, по мнению A. Tripathi и соавт., будет восприниматься врачами как клинически негативный результат [7]. Напротив, внутрикожные тесты с коммерческими экстрактами аллергенов мяса или прик-тесты со свежим мясом четко демонстрируют положительные результаты [4, 5]. Однако эксперты по ПА не рекомендуют ставить внутрикожные пробы с пищевыми аллергенами, тогда как прик-прик-тесты признаны наиболее достоверным методом обследования, в частности, больных с оральным аллергическим синдромом [17]. Техника проведения прик-прик-теста проста: после прокалывания продукта (используют сырое и вареное мясо различных видов млекопитающих) с помощью ланцета, сразу этим же ланцетом прокалывают саму кожу, а оценку результатов проводят аналогично кожным пробам [17, 18].
В случаях, когда нельзя поставить кожные пробы или их результаты отрицательны, пациенту назначают определение уровня специфических IgE в сыворотке крови (такой диагностический метод не имеет никаких противопоказаний) [17]. По данным литературы, у больных с аллергией на мясо уровни специфических IgE к различным видам мяса были неизменно повышены [4–7, 19].
Учитывая перекрестную реактивность, таким пациентам необходимо также назначить определение уровня специфических IgE к ряду других пищевых продуктов (коровье молоко, бычий желатин, α-gal, эпителий собаки/кошки). Для этого используют коммерческие экстракты (например, тест-системы Immulite, ImmunoCAP). Положительным считается уровень специфических IgE > 0,35 мЕ/мл. Определение уровня IgE антител к α-gal показано не только всем больным с аллергией на мясо, но и в двух других случаях: перед назначением цетуксимаба и при подозрении на замедленную анафилаксию, вызванную α-gal [7, 19]. Между тем исследования показали, что
1% детей, проживающих в Стокгольме (район, где нет клещей), имел положительный анализ IgE к α-gal, а в США такой результат был получен у 20% больных [5, 20]. Уровень специфических IgE к α-gal ≥ 0,35 kE/l обнаружен у 1,8% и 2,2% популяции взрослых жителей Дании и Испании соответственно, что коррелировало с укусом клещей в анамнезе, наличием атопии и кошки в доме [21]. Данные из Австралии, Швеции и США указывают, что основной причиной наличия специфических IgE к α-gal был укус клещей. В то же время из 207 пациентов с болезнью Лайма 22% из них имели повышенный уровень IgE к α-gal и достоверную связь с B-отрицательной группой крови [22]. Повышенный уровень специфических IgE к α-gal обнаружен в том числе у многих африканских детей, которые никогда не имели неблагоприятных реакций на мясо млекопитающих [5].
В целом полученные результаты кожных и in vitro тестов с использованием мясных экстрактов подтверждают низкую чувствительность обоих методов [5, 20]. Действительно, часто степень тяжести клинических реакций на мясо не коррелирует с данными аллергологического обследования. Это связано со многими общеизвестными причинами (изменение аллергенности мяса при получении экстракта из-за метода экстракции/теплового воздействия; источника мяса и т. п.), которые в конечном итоге могут привести к сильным отличиям результатов, полученных в разных лабораториях и даже странах. Кроме того, результаты кожных проб и определения уровня специфических IgE в сыворотке крови не являются взаимозаменяемыми, особенно у детей [23].
Недавние исследования показали, что результаты прик-прик-проб являются более точными в случае использования свежего мяса говядины и свинины, поскольку они содержат больше α-gal, чем коммерческие экстракты аллергенов [5, 7]. Некоторые авторы рекомендуют проведение кожных проб с препаратом цетуксимабом (как источника эпитопа α-gal) в концентрациях 5, 50 и 500 мкг [9, 24]. По данным R. Mullins большинство пациентов с аллергией на красное мясо имели также клинически аллергию на желатин [15]. Некоторые ученые с диагностической целью дополнительно применяли патч-тесты с подозреваемым аллергеном, хотя, по заключению экспертов, их использование при диагностике ПА не оправдано [17].
В качестве дополнительного диагностического инструмента предложен тест активации базофилов с помощью цетуксимаба, при котором повышенная экспрессия CD63 коррелировала с клиническими симптомами [24]. Причем, по данным S. Commins и соавт., активация базофилов в крови больных, у которых обнаруживали специфические IgE к α-gal, не отмечалась через 120 мин после потребления мяса (антиген, видимо, не попадает в кровяное русло ранее 3–5 ч после приема мяса млекопитающих) [25]. Уровень триптазы повышен в крови больных с замедленной анафилаксией.
Как правило, проведение пищевых провокационных проб не показано, если анамнез болезни и аллергологическое обследование подтверждают пищевую гиперчувствительность.
Таким образом, в развитии аллергической реакции на мясо могут быть задействованы термолабильные белки, α-gal, желатин и другие компоненты. Хотя приготовление продукта изменяет реактивность аллергенов и снижает сенсибилизацию к мясу, сопутствующие факторы (например, физические упражнения), количество съеденного мяса; содержание в нем других возможных аллергенов; кулинарная обработка и т. п.) также могут играть важную роль в инициации неблагоприятных реакций на мясо. Кроме того, возможно, потребление большого количества мяса вечером повышает сократительную способность кишечника и тем самым влияет на абсорбцию аллергенов [4, 7].
Клиника
Аллергия на мясо включает несколько клинических проявлений, которые не представляют диагностических затруднений при IgE-опосредованных реакциях (табл. 1) [5]. Они могут варьировать от легкого зуда в полости рта, боли в животе и диареи до ангионевротического отека. Самое тяжелое проявление аллергии на мясо — анафилаксия. В течение 30 мин после употребления мяса у такого пациента могут появиться симптомы вовлечения одной или нескольких систем: генерализованная крапивница, одышка, свистящее дыхание; тошнота, рвота, боль в животе; или сосудистый коллапс (гипотензия, спутанность/потеря сознания, недержание мочи, головокружение, потливость).
Напротив, замедленное появление аллергических симптомов у α-gal-сенсибилизированных пациентов создает определенные сложности в диагностике. Однако ряд уникальных особенностей, присущих данному синдрому, помогут врачу вовремя поставить правильный диагноз (табл. 2) [5]. В частности, чаще всего развитие симптомов происходит через 3–7 ч после приема красного мяса; ранее все эти пациенты потребляли мясо без каких-либо неблагоприятных реакций; в-третьих, большинство из них не имело никаких аллергических симптомов, включая бронхиальную астму [9].
При сборе анамнеза важно расспросить пациента о возможных укусах клещей (которые, как правило, имели место до появления аллергии на мясо). Есть характерная особенность: в подобных случаях укус клещей сопровождается выраженным локальным зудом в течение 10 дней и более [7, 19]. Напротив, зуд при болезни Лайма (подтвержденной позитивным серологическим результатом на Borrelia burgdorferi) слабый [19]. Клиницистам следует рассматривать замедленную анафилаксию на красное мясо как одну из возможных причин идиопатической анафилаксии [7].
Другая реакция — синдром «кошка–свинина» развивается только после приема свинины, в основном, у пациентов зрелого возраста, имеющих первичную сенсибилизацию к альбумину кошки. Большинство больных жалуется на спастические боли в животе, тошноту, зуд кожи, крапивницу, которые появляются в течение 1 часа (через 20–45 мин) после употребления свинины или в неясных случаях — вообще после еды [6]. К гастроинтестинальным симптомам могут присоединиться головокружение, гипотензия и другие симптомы анафилаксии, которые при благоприятном исходе самопроизвольно проходят в течение 45–60 мин. Иногда у таких больных отсутствуют тошнота, рвота или диарея. J. Posthumus и соавт. из многочисленной группы пациентов с подозрением на аллергию на мясо в 8 случаях диагностировали синдром «кошка–свинина» и подробно описали его клинику [6]. Диагноз болезни был установлен на основании анамнеза болезни, оценки уровня специфических IgE и клинического ответа на элиминационную диету (пищевые провокационные пробы не проводили). Анализ собственных и литературных данных позволил ученым сформулировать четыре наиболее характерных особенностей, присущих синдрому «кошка–свинина»:
- Сенсибилизация к свинине не возникает на ранних этапах жизни больного: большинство таких случаев описано у детей в возрасте старше 8 лет, но чаще — у взрослых. В ряде случаев «новой пищевой аллергии» у детей школьного возраста или взрослых следует исключить, в том числе, синдром «кошка–свинина».
- Пациенты не всегда сообщают о реакциях при каждом приеме свинины: триггером аллергических реакций могут быть также сушеная/копченая свинина (барбекю).
- Как протекает синдром «кошка–свинина» в динамике, не ясно. Возможно, уровень специфических IgE к сывороточному альбумину кошки с течением времени снижается, а постоянно продолжающийся контакт с кошкой и сохраняющаяся сенсибилизация объясняют, почему некоторые пациенты в конечном итоге безопасно потребляют свинину.
- Реакция на свинину начинается вскоре после потребления мяса [6].
Иногда под маской аллергии на мясо протекает анизакидоз — паразитарная инвазия Anisakis simplex (нематодные паразиты рыб через корм могут попасть в организм млекопитающих и домашних птиц) [18].
Лечение
Профилактические меры включают исключение потребления красного мяса. Таких больных подробно информируют также о риске перекрестного загрязнения, особенно при еде вне дома, и выдают подробный план лечения. Лечение анафилаксии у больных всех возрастов включает незамедлительное введение адреналина подкожно, глюкокортикостероидов и физиологического раствора внутривенно [34]. За рубежом используют аутоинъектор адреналина, который после соответствующего обучения сам себе вводит пациент в необходимых случаях. Поскольку пожилые люди, страдающие сердечно-сосудистыми заболеваниями, особенно плохо переносят адреналин, им взамен можно рекомендовать использование дифенгидрамина перорально или внутримышечно, если нет прямых показаний для срочного введения адреналина.
Лечение и профилактика анафилаксии:
- Обеспечить проходимость дыхательных путей и нормальную деятельность кровообращения.
- Адреналин для инъекций.
- Димедрол.
- Кортикостероиды.
- Паспорт аллергика (идентификационный браслет).
- Исключение потребления продуктов из красного мяса, включая говядину, свинину и баранину.
- Направить такого пациента к аллергологу-иммунологу для дальнейшего обследования и лечения.
Всем пациентам с аллергией на красное мясо млекопитающих рекомендуют избегать укуса клещей (использовать защитную одежду и специальные средства при посещении эндемических мест, особенно в жаркие месяцы). Вводить коллоидные растворы (различные операционные вмешательства, инфаркт миокарда и т. д.) больным с аллергией на желатин и бычьи протеины противопоказано [7].
Таким образом, знание клинических особенностей течения аллергии на мясо помогут врачам в постановке диагноза и назначении правильного лечения.
Приводим описание клинических случаев замедленной анафилаксии на мясо млекопитающих. Мы не встречали описания подобных случаев в России [26].
Цель работы. За период 08.2012–12.2014 г. к аллергологу-иммунологу медицинского центра г. Урус-Мартана (Чечня) обратились 309 пациентов по поводу острой крапивницы и 314 пациентов с атопическим дерматитом, которые обострение болезни связывали с ПА. Среди них аллергия на мясо встречалась крайне редко. Мы сообщаем о 4 пациентах, которые имели все клинические признаки замедленной анафилаксии на мясо.
Методы обследования. Всем пациентам с подозрением на аллергию на мясо были поставлены прик-прик-тесты на сырое и вареное мясо, а также прик-тесты коммерческими экстрактами эпидермальных аллергенов (табл. 3).
Результаты. У всех больных с аллергией на мясо клинические симптомы заболевания полностью соответствовали замедленной анафилаксии: крапивница, удушье, диарея появлялись через 2–6 часов после потребления мяса млекопитающих. Кроме того, все они в анамнезе имели укус клещей. Прик-прик-тесты на сырое мясо баранины и соус барбекю были резко положительными в 100% случаев (рис.).
Предположительно, основной причиной подобной формы ПА на мясо является сенсибилизация к гликопротеину α-gal. У наблюдаемых нами пациентов она, видимо, была связана с укусом клещей. Лечение включает: обучение таких пациентов; исключение потребления красного мяса и профилактика повторных укусов клещей; адреналин — при тяжелой аллергической реакции.
.jpg)
- Theler B., Brockow K., Ballmer-Weber B. Clinical presentation and diagnosis of meat allergy in Switzerland and Southern Germany // Swiss Med Wkly. 2009; 139: 264–270.
- Werfel S., Cooke S., Sampson H. Clinical reactivity to beef in children allergic to cow’s milk // J Allergy Clin Immunol. 1997; 99: 293–300.
- Restani P., Ballabio C., Tripodi S., Fiocchi A. Meat allergy // Curr Opin Allergy Clin Immunol. 2009; 9: 265–269.
- Commins S., Satinover S., Hosen J. et al. Delayed anaphylaxis, angioedema, or urticaria after consumption of red meat in patients with IgE antibodies specific for galactose-alpha-1,3-galactose // J Allergy Clin Immunol. 2009; 123: 426–433.
- Saleh H., Embry S., Nauli A. et al. Anaphylactic reactions to oligosaccharides in red meat: a syndrome in evolution // Clin Mol Allergy. 2012; 10: 5.
- Commins S., Platts-Mills T. Tick bites and red meat allergy // Curr Opin Allergy Clin Immunol. 2013; 13: 354–359.
- Tripathi A., Commins S., Heymann P., Platts-Mills T. Delayed anaphylaxis to red meat masquerading as idiopathic anaphylaxis // J Allergy Clin Immunol Pract. 2014; 2: 259–265.
- Hamsten C., Starkhammar M., Tran T. еt al. Identification of galactose-alpha-1,3-galactose in the gastrointestinal tract of the tick Ixodes ricinus; possible relationship with red meat allergy // Allergy. 2013; 68: 549–552.
- Berg E., Platts-Mills T., Commins S. Drug allergens and food — the cetuximab and galactose-α-1,3-galactose story // Ann Allergy Asthma Immunol. 2014; 112: 97–101.
- Apostolovic D., Tran T., Hamsten C. et al. Immunoproteomics of processed beef proteins reveal novel galactose-α-1,3-galactose-containing allergens // Allergy. 2014; 69: 1308–1315.
- Davis P., Williams S. Protein modification by thermal processing // Ibid. 1998; 53 (46 Suppl): 102–105.
- Fiocchi A., Restani P., Riva E. Beef allergy in children // Nutrition. 2000; 16 (6): 454–457.
- Mullins R. Anaphylaxis: risk factors for recurrence // Clin Exp Allergy. 2003; 33: 1033–1040.
- Drouet M., Lauret M., Sabbah A. The pork-cat syndrome: effect of sensitization to cats on sensitization to pork meat. Apropos of a case // Allerg. Immunol (Paris). 1994; 26: 305–306.
- Mullins R. The relationship between red meat allergy and sensitization to gelatin and galactose-alpha-1,3-galactose // J Allergy Clin Immunol. 2012; 129: 1334–1342.
- Posthumus J., James H., Lane C. et al. Initial description of pork-cat syndrome in the United States // Ibid. 2013; 131: 923–925.
- Boyce J., Assa’ad A., Burks A. et al. Guidelines for the diagnosis and management of food allergy in the United States: report of the NIAID-sponsored expert panel // Ibid. 2010; 126 (6 Suppl): S1–S58.
- Мачарадзе Д. Ш. Пищевая аллергия: клиника, диагностика, лечение. Методическое пособие. (В печати).
- Chung C., Mirakhur B., Chan E. et al. Cetuximab- induced anaphylaxis and IgE specific for galactose-alpha-1,3-galactose // N Engl J Med. 2008; 358: 1109–1117.
- Carrapatoso I., Zavala B., Ribeiro F. et al. Allergy to red meat in adulthood: a case report // J Investig Allergol Clin Immunol. 2014; 24: 206–208.
- Gonzalez-Quintela A., Dam Laursen A., Vidal C. et al. IgE antibodies to alpha-gal in the general adult population: relationship with tick bites, atopy, and cat ownership // Clin Exp Allergy. 2014; 44: 1061–1068.
- Hamsten C., Tran T., Starkhammar M. et al. Red meat allergy in Sweden: association with tick sensitization and B-negative blood groups // J Allergy Clin Immunol. 2013; 132: 1431–1434.
- Schoos A.-M., Chawes B., Følsgaard N. et al. Disagreement between skin prick test and specific IgE in young children // Allergy. 2015; 70: 41–48.
- Michel S., Scherer K., Heijnen I., Bircher A. Skin prick test and basophil reactivity to cetuximab in patients with IgE to alpha-gal and allergy to red meat // Ibid. 2014; 69: 403–405.
- Commins C., James H., Stevens W. et al. Delayed clinical and ex vivo response to mammalian meat in patients with IgE to galactose-alpha-1,3-galactose // J Allergy Clin Immunol. 2014; 134: 108–115.
- Адаева-Янаева Х. А., Муслимова З. А., Мачарадзе Д. Ш. Замедленная анафилаксия на мясо у взрослых: случаи из практики. Международный форум «Аллергология и иммунология. Взгляд в будущее». Тезисы. Москва, 26–28 января 2015 г.
Х. А. Адаева-Янаева*
З. А. Муслимова*
Д. Ш. Мачарадзе** , 1 , доктор медицинских наук, профессор
* Лечебно-диагностический центр «Планета здоровья», Урус-Мартан
** ГБОУ ВПО РУДН, Москва
Источник
Среди множества дерматологических и хирургических проблем особого внимания заслуживают фурункул и карбункул кожи.
Абсцесс кожи
Это гнойная полость, ограниченная от здоровых тканей пиогенной (гнойной) оболочкой, процесс развития которой сопровождается выраженной интоксикацией организма (высокой температурой, ознобом, резкой слабостью).

Кроме выше упомянутого стафилококка, возбудителями могут выступать также стрептококк, кишечная и синегнойная палочка.
Симптомы абсцесса кожи зависят от причин развития процесса, его локализации и площади поражения. Сначала появляется отек и покраснение участка кожи с местным повышением температуры. Затем происходит разрастание размеров пораженной области, в центре которой начинает скапливаться гной, а по мере увеличения его количества появляется характерные для абсцесса желтизна, болезненность и чувство распирания. После этого размеры патологического очага изменяются незначительно, однако общее состояние продолжает быстро ухудшаться. Кроме того, в зависимости от расположения гнойная полость влияет и на функциональность организма. Например, при поражении бедра очень болезненна становится обычная ходьба, а в запущенных случаях – даже просто попытки движения ногой.
При отсутствии квалифицированной медицинской помощи абсцесс может вскрыться самостоятельно, при этом общее состояние заметно улучшается. Однако в данном случае благополучный исход самостоятельного заживания является редкостью – зачастую наблюдаются серьезные последствия.



Осложнения абсцесса:
- распространение инфекции на соседние участки кожи;
- при прорыве в прилегающие ткани (а не наружу) возможно развитие разлитых гнойных воспалений – флегмоны или панникулита;
- лимфадениты, тромбофлебиты;
- сепсис.
Адекватное и эффективное лечение возможно только в условиях стационара. На начальных стадиях возможны консервативные методы, при наличии гноя – хирургическое вмешательство аналогично принципам лечения карбункула.

Источник


